一种白色固体可能由Na+、Ba2+、Cl-、Br-、HCO3-、SO32-、SO42-离子中的若干种组成,陶宝同学设计实验检验其组成,记录如下:
| 步骤 |
实验操作 |
实验现象 |
| ① |
将固体溶于水,用pH试纸检验 |
无色溶液pH=9 |
| ② |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
产生气泡,CCl4层呈橙色 |
| ③ |
向②所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
| ④ |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列关于固体组成的结论错误的是
A.肯定含有Br-,可能含有HCO3-
B.至少含有SO32-、SO42-中的一种离子
C.肯定不含Ba2+,一定含有Cl-
D.无需焰色反应即可断定溶液中含有Na+
根据平衡移动的原理,能说明提高氨的产量的措施是( )
| A.及时把生成的氨液化分离 |
| B.升温有利于氨的生成 |
| C.使用催化剂促进氮的转化 |
| D.增大压强,不利于氨的生成 |
检验小苏打粉末中是否有苏打的方法是 …( )
| A.溶于水,加Ca(OH)2溶液 |
| B.溶于水,加稀CaCl2溶液 |
| C.加稀盐酸 |
| D.溶于水,加入NaOH溶液 |
合成氨反应N2+3H2 2NH3的正逆反应速率可用反应物或生成物浓度的变化来表示。下列各关系中,能说明反应已达到平衡状态的是( )
2NH3的正逆反应速率可用反应物或生成物浓度的变化来表示。下列各关系中,能说明反应已达到平衡状态的是( )
A.3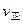 (N2)= (N2)=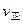 (H2) (H2) |
B.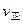 (H2)= (H2)=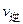 (NH3) (NH3) |
C.2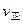 (H2)=3 (H2)=3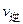 (NH3) (NH3) |
D.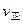 (N2)=3 (N2)=3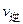 (H2) (H2) |
关于接触法制硫酸的叙述中,不正确的是( )
| A.从沸腾炉出来的炉气必须净化,主要目的是防止催化剂中毒 |
| B.之所以叫“接触法”是因SO2被氧化成SO3时反应是在催化剂表面进行的 |
| C.黄铁矿粉碎成细小矿粒,在沸腾炉中燃烧快、反应完全,提高了原料的利用率 |
| D.SO3用稀硫酸吸收而不用水吸收,可防止形成酸雾并使SO3吸收完全 |
在合成氨时,可以提高H2转化率的措施是()
| A.延长反应时间 | B.充入过量H2 | C.充入过量N2 | D.升高温度 |