25℃时,水的电离达到平衡:H2O H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
下列分离、提纯、鉴别物质的方法正确的是( )
| A.用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
| B.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| C.用过滤的方法除去蔗糖溶液中含有的少量淀粉胶体 |
| D.用加热、过滤、蒸发的方法可以除去粗盐中的泥沙、CaCl2、MgCl2等杂质 |
下列实验目的可以实现或操作正确的是()
| A.用50mL的量筒量取45.50mL的水 |
| B.将40 gNaOH溶解于1 L水中配得1mol/L的溶液 |
| C.CCl4萃取碘水的实验中,分液时,水层液体从下口流出 |
| D.稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌 |
以下实验装置一般不用于分离物质的是()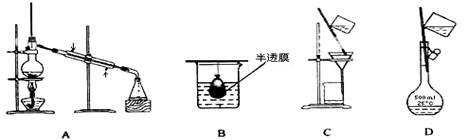
用BaCl2检验SO42-离子时,先在待测溶液中加入盐酸,其作用是()
| A.形成较多的白色沉淀 | B.排除SO42-以外的其它阴离子及Ag+的干扰 |
| C.形成的沉淀纯度更高 | D.排除Ba2+以外的其它阳离子的干扰 |
下列有关氧化还原反应的说法中,正确的是()
| A.在氧化还原反应中,非金属单质一定是氧化剂 |
| B.还原剂在反应中发生还原反应 |
| C.氧化还原反应的本质是电子的转移 |
| D.有单质生成的反应一定是氧化还原反应 |