某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始pH |
废水样品体积/mL |
草酸溶液体积/mL |
蒸馏水体积/mL |
| ① |
4 |
B= |
10 |
30 |
| ② |
5 |
60 |
10 |
d= |
| ③ |
a= |
60 |
c= |
20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。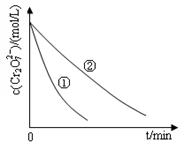
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
| 取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 |
反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
| 组数 |
1 |
2 |
3 |
4 |
| 消耗V(KMnO4)/ml |
20.04 |
20.00 |
18.90 |
19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)
实验室里用一般的气体发生装置来制备Cl2,反应物即使在停止加热后反应还会继续一段时间,当要收集多瓶Cl2时,常有较多的Cl2逸散到空气中去,为了避免Cl2的逸散,并对多余的Cl2随时取用,有人设计了如下图的甲装置来制取Cl2: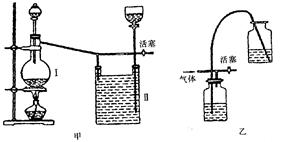
(1)设计甲装置是依据了(填已学某仪器名称)的原理。甲中装置
Ⅱ(填能或不能)用乙装置来代替。
(2)甲中Ⅱ中盛有的液体是,该装置可看作是一个(填某仪器名称),简述其主要原理:
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移的方向和数目。
(2)B处盛有饱和食盐水(或水),其作用是。
(3)C处盛放的试剂__________(填名称),其作用是。 (4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(5)实验结束时,应先熄灭__________处酒精灯。
“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(SO42-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是。
(2)显色时间t2=。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为(填字母)
A <22.0sB22.0~44.0sC>44.0sD数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是。
化学活动课上,三组学生分别用图示甲、乙两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。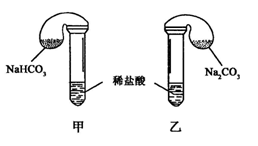
请回答:
(1) 各组反应开始时,装置中的气球体积先变大,该装置中反应的离子方程式是______。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 组 数 |
试剂用量 |
实验现象 (气球体积变化) |
分析原因 |
① |
0.42 g NaHCO3;0.53g Na2CO3;3mL4 mol·L-1盐酸 |
甲中气球与乙中气球的体积相等 |
甲、乙盐酸均过量,n(NaHCO3)=n(Na2CO3),ν甲(CO2)=ν乙(CO2) |
② |
0.3 g NaHCO3;0.3 g Na2CO3;3mL4 mol·L-1盐酸 |
甲中气球比乙中气球的体积大 |
|
③ |
0.6 g NaHCO3;0.6 g Na2CO3;3mL 2mol·L-1盐酸 |
甲中气球比乙中气球的体积大 |
|
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
(用离子方程式表示) |
请你选用下图所示仪器和药品,按实验室要求,设计一套完整的检验一氧化碳还原性和二氧化碳化学性质的实验,并回答下列问题: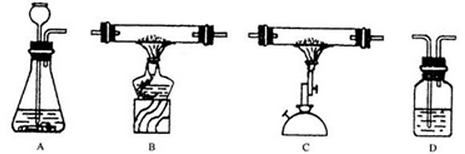
实验药品:盐酸、石灰石、氧化铜粉末、木炭粉、氢氧化钙溶液。
(1)实验装置连接顺序依次为(用字母表示)___________;
(2)A装置的药品是_________,发生反应的化学方程式为_______________________;
(3)B装置中产生的实验现象是_________,发生反应的化学方程式为____________
(4)C装置中发生反应的化学方程式为____________________________________;
(5)D装置中产生的现象是_________;
(6)尾气中含有毒气体,排放到空气中会造成污染,处理方法是_________。