500 mL 1 mol/L的稀HCl与锌粒反应,不会使反应速率加快的是
| A.升高温度 |
| B.将500 mL 1 mol/L的HCl改为1000 mL 1 mol/L的HCl |
| C.用1 mol/L的H2SO4代替1 mol/L的HCl |
| D.用锌粉代替锌粒 |
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1 mol·L-1,某同学进行了如下实验:
下列说法正确的是
| A.无法确定原试液中是否含有Al3+、Cl- |
| B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ |
| C.无法确定沉淀C的成分 |
| D.原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- |
下列说法正确的是
| A.NA代表阿伏加德罗常数,1molC4H10中含共价键数目为14NA。 |
| B.某反应的△H =-88kJ·mol-1,则正反应活化能一定小于88kJ·mol-1。 |
| C.已知某温度下,Kw=l×10-13,若将pH=8的NaOH溶液与pH=5的H2SO4溶液混合,保持温度不变,欲使混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为11︰9 |
D.将浓度为0.1 mol·L-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变, 始终保持增大 始终保持增大 |
下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是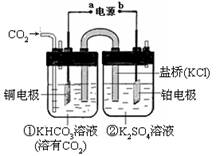
| A.该过程是电能转化为化学能的过程 |
| B.一段时间后,①池中n(KHCO3)不变 |
| C.一段时间后,②池中溶液的pH一定下降 |
| D.铜电极的电极反应式为:CO2+8H++8e-==CH4+2H2O |
下列说法不正确的是
| A.某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 |
| B.某有机化合物完全燃烧生成等物质的量的CO2和H2O,则该有机物的分子式一定CnH2n |
| C.甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 |
| D.HOCH2COOH既可发生取代反应,也可发生加聚反应 |
元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是 
| A.③元素形成的单质晶体均属于原子晶体 |
| B.④元素的气态氢化物易液化,是因为其分子间存在氢键 |
| C.②、⑦、⑧对应的简单离子半径依次减小 |
| D.实验室可根据⑥、⑦单质分别与⑤单质反应的难易程度来比较两元素的非金属性强弱 |