某无色酸性溶液中能大量共存的离子组是
| A.K+、Mg2+、Cl-、NO3- | B.Ba2+、SO42-、Cl-、OH- |
| C.K+、OH-、CO32-、MnO4- | D.Ca2+、K+、Cl-、HCO3- |
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
| A.所有元素原子的最外层电子数都等于元素的最高化合价 |
| B.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 |
| C.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
下列叙述正确的是( )
| A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
| B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同 |
| C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 |
| D.过量的铜与浓硝酸反应,生成的气体只有NO2 |
下列各实验装置图的叙述中,正确的是( )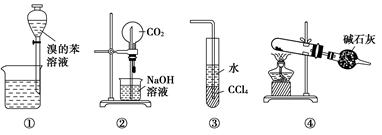
| A.装置①为放出萃取溴水后的苯层 |
| B.装置②为喷泉实验 |
| C.装置③可用来吸收HCl气体 |
| D.以NH4Cl为原料,装置④可用于制备少量NH3 |
设NA表示阿伏加德罗常数的数值,下列判断正确的是( )
| A.常温常压下,22.4 L CH4中含有的C—H键数为4NA |
| B.4.6 g由NO2和N2O4组成的混合气体中含有的氧原子数为0.3NA |
| C.含0.2 mol H2SO4的浓硫酸与足量Cu反应,生成SO2的分子数为0.1NA |
| D.1 mol Na在足量O2中燃烧生成Na2O2,钠失去的电子数为NA |
下列说法正确的是( )。
| A.将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| B.在中和热的测定实验中,应先分别测出盐酸和NaOH溶液的温度,再将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,充分反应后再读出并记录反应体系的最高温度 |
| C.在试管中将一定量的浓硝酸,浓硫酸和苯混合,用酒精灯直接加热几分钟,即可制得硝基苯 |
| D.溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体就越细小 |