设NA表示阿伏加德罗常数,下列说法正确的是
| A.标准状况下,22.4LSO3含有NA个分子 |
| B.标准状况下,22.4LCO2与CO的混合气体含NA个分子 |
| C.1molNa2O2与足量CO2反应转移的电子数为NA |
| D.常温下NA个H2分子的质量约为2g,它所占的体积约为22.4L |
某学生的实验报告所列出的下列数据中合理的是
| A.用10mL量筒量取7.13mL稀盐酸 |
| B.用托盘天平称量25.20g NaCl |
| C.用广泛pH试纸测得某溶液的pH为2.3 |
| D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL |
下列关于水的电离不正确的是
| A.加酸或碱一定抑制水的电离 |
| B.加盐一定促进水的电离 |
| C.升高温度,水的pH值变小 |
| D.常温下任何稀的酸、碱、盐水溶液中KW=10-14 |
下列叙述中,不能用勒夏特列原理解释的是
| A.红棕色的NO2,加压颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.加入催化剂有利于氨的合成 |
D.工业制取金属钾Na(l)+KCl(l) NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
某温度下,反应SO2(g)+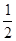 O2(g)
O2(g) SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g) 2SO2(g)+O2(g)的平衡常数K2的值为
2SO2(g)+O2(g)的平衡常数K2的值为
| A.2500 | B.100 | C.4×10-4 | D.2×10-2 |
纳米钴(Co)是加氢反应的催化剂,500K时催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) △H<0。有关说法正确的是
CH4(g)+H2O(g) △H<0。有关说法正确的是
| A.纳米技术的应用,提高了催化剂的催化性能,但平衡常数不变 |
| B.缩小容器体积,平衡向正反应方向移动CO的浓度减小 |
| C.温度越低,越有利于CO催化加氢 |
| D.从平衡体系中分H2O(g)能加快正反应速率 |