下列说法正确的是
| A.水的离子积KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
| C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4C1晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的比值增大 |
D.室温下,CH3COOH的 ,NH3·H2O的 ,NH3·H2O的 ,CH3COOH溶液中的c (H+)与NH3·H2O中的c(OH-)相等 ,CH3COOH溶液中的c (H+)与NH3·H2O中的c(OH-)相等 |
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
| A.该反应进行到M点放出的热量大于进行到W点放出的热量 |
B.T2下,在0~t1时间内,v(Y)=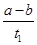 mol/(L·min) mol/(L·min) |
| C.M点的正反应速率v正大于N点的逆反应速率v逆 |
| D.M点时再加入一定量的X,平衡后X的转化率减小 |
下列离子方程式书写正确的是
| A.向漂白粉溶液中通入少量SO2气体:Ca2++ClO-+SO2+H2O===CaSO4↓+2H++Cl- |
| B.向盐酸中逐滴加入等体积等浓度的碳酸钠溶液:CO32-+2H+==CO2↑+H2O |
| C.KHC2O4使酸性KMnO4溶液褪色:5C2O42-+16H++2MnO4-===10CO2↑+ 2Mn2++8H2O |
| D.向银氨溶液中加入足量的氢碘酸溶液:〔Ag(NH3)2〕++OH-+3H+= Ag++H2O +2NH4+ |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl;2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是
| A.酸性(水溶液):HSCN > H2CO3 > HCN |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 |
下列分类正确的是
| 酸性氧化物 |
电解质 |
高分子化合物 |
|
| A |
NO2 |
纯碱 |
葡萄糖 |
| B |
石英 |
氨水 |
淀粉 |
| C |
Mn2O7 |
H2O |
锦纶 |
| D |
醋酸酐 |
HCl |
油脂 |
下列说法正确的是
| A.酸性高锰酸钾溶液与草酸溶液的反应速率是先慢后快再变慢 |
| B.碳酸钠是发酵粉的主要成分,而碳酸氢钠是治疗胃穿孔的一种药剂 |
| C.一般用稀的(NH4)2SO4溶液分离提纯鸡蛋清溶液 |
| D.工业上为了加快分离胶体中的电解质杂质,常在渗析袋外施加电场,使电解质离子透过半透膜向两极移动,该操作是应用胶体的电泳原理 |