某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)  C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
| t/s |
0 |
5 |
15 |
25 |
35 |
| m (A)/mol |
1.0 |
0.85 |
0.81 |
0.80 |
0.80 |
A.反应在前5 s的平均速率v(A)=0.17mol∙L-1∙s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol∙L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前V(正)<V(逆)
一定温度和压强下,1体积X2(气)和3体积Y2(气)化合生成2体积气态化合物,则该化合物的化学式
| A.XY3 | B.XY | C.X3Y | D.X2Y3 |
设nA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.1.8 g的NH4+中含有的电子数为1.1nA |
| B.常温常压下,11.2 L氮气所含的原子数为nA |
| C.常温常压下,48 g O2中含有的分子数为1.5nA |
| D.标准状况下,2.24 L四氯化碳(CCl4)中含有的分子数为0.1 nA |
配制一定物质的量浓度的盐酸溶液时,下列操作可使所配制溶液浓度偏高的是
| A.用量筒量取浓盐酸俯视读数 |
| B.溶解搅拌时有液体飞溅 |
| C.定容时俯视容量瓶瓶颈刻度线 |
| D.摇匀后见液面下降,再加水至刻度线 |
从平时学生实验中我们发现,同学们在进行实验时出现许多不正确的操作方式,希望 同学们在今后的实验中,应该克服不规范的操作。请找出下列图示中正确的实验操作
同学们在今后的实验中,应该克服不规范的操作。请找出下列图示中正确的实验操作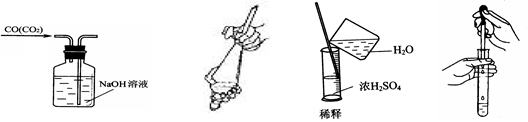

| A.除去CO的CO2 | B.萃取时振荡混合液 | C.稀释浓硫酸 | D.向试管中滴加液体 |
研究物质的组成和结构,常要对物质进行分离和提纯。下列装置或操作一般不用于物质分离提纯的是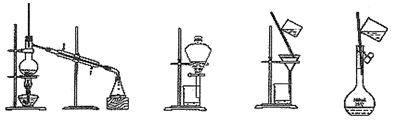
A. B. C. D.