【化学—选修2化学与技术】(15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:____________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 |
T/K |
大理石 规格 |
HNO3浓度(mol·L-1) |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响;) |
| ② |
||||
| ③ |
||||
| ④ |
(2)实验①中CO2质量随时间变化的关系见下图:依据反应方程式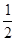 CaCO3+HNO3=
CaCO3+HNO3=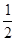 Ca(NO3)2+
Ca(NO3)2+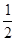 CO2↑+
CO2↑+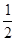 H2O,计算实验①在70~90 s范围内HNO3的平均反应速率为 。(可用分数表示)
H2O,计算实验①在70~90 s范围内HNO3的平均反应速率为 。(可用分数表示)
(3)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。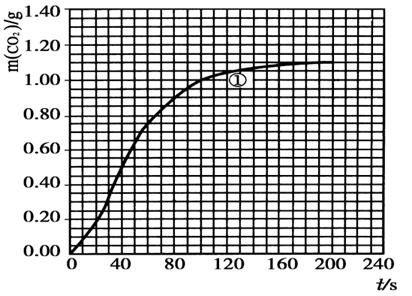
草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾、硫酸钾。现从草木灰中提取钾盐,并用实验检验其中的 CO32—、 SO42—和 Cl—。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称取样品,②溶解,③,④,⑤冷却结晶。
(2)将制得的少量晶体放入试管,加入蒸馏水溶解并把溶液分成三份,分装在3支试管里。
①在第一支试管里加入稀盐酸,可观察有生成,证明溶液中有离子。
②在第二支试管里加入足量稀盐酸后,再加入,可观察到有生成,证明溶液中有离子;写出相关的化学方程式;
判断所加入稀盐酸已经足量的方法是_______________________。
③在第三支试管里加适量的硝酸银,观察到有沉淀产生,由此证明溶液中一定含Cl—、。你认为该结论是否严密?为什么?
。
如图所示是中学化学实验中常见的装置,它有多种用途。
(1)若瓶中装有X溶液,将CO和CO2的混合气体由a管口通入,用以除去CO2,则X为________。
| A.H2SO4 | B.NaOH | C.NaCl | D.HCl |
(2)若用排水法收集H2,则H2气体应从_______(填标号,下同)管口导入;若用排空气法收集CO2,则CO2气体应从________ 管口导入。
(3)医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装有水的该装置,观察气泡产生的情况,以便调节供氧速率,此时氧气应从管口导入。
可用于分离或提纯物质的方法有:①过滤②蒸馏③加热④分液⑤结晶法⑥蒸发⑦萃取(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒
(2)除去NaCl晶体中混有的碘单质
(3)分离石油中各不同沸点范围的成分
(4)分离水和CCl4的混合物
(5)除去 KCl 中少量 KClO3
(6)CCl4与甲苯的混合物
(已知CCl4与甲苯互溶,沸点分别为76.75 ℃和110.6 ℃)
(7)提取NaCl和KNO3混合溶液中的KNO3
下图中各仪器的名称分别是: