某不纯的碳酸钠固体样品,含有的杂质可能是NaNO3、CaCO3、CuSO4、NaCl四种物质中的一种或几种。为确定其杂质的成分,进行了如下实验:
试根据实验过程和发生的现象填写以下空白:
(1)常温下,气体C的水溶液的pH_______7(填“大于”“小于”“等于”之一)。
(2)操作1的名称是__________。
(3)根据上述实验,证明样品中,一定不存在的物质是(写化学式)_______________。
(4)根据上述实验,已经证明了溶液B中存在的物质有(写化学式)_________。
(5)仅根据上述实验现象,还不能确定是否混入样品中的物质是_____________。
(6)写出生成白色沉淀A反应的化学方程式____________________________________。
现有下列仪器: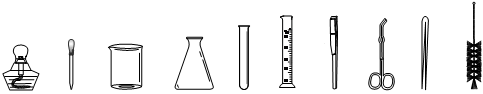
(1)吸取和滴加少量液体时用_________,用于洗试管的仪器是(填仪器名称)
(2)家庭小实验通常利用生活中常见的物品做一些实验仪器的替代品,你认为医用注射器可以代替上述仪器中的、。
(3)取用一定量液体试剂,需使用的仪器有。
下表列出了1~18号元素的原子序数和元素符号
| 原子序数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
| 元素符号 |
H |
He |
Li |
Be |
B |
C |
N |
O |
F |
| 原子序数 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
| 元素符号 |
Ne |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
(1)1~18号元素中属于稀有气体元素的有(填元素符号)。
(2)1~18号元素中最外层有2个电子的原子有(填元素符号)。
(3)某元素的原子结构示意图为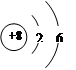 ,它在化学反应中一般易电子(填“得
,它在化学反应中一般易电子(填“得
到”或“失去”)
(4)我们生活的世界由丰富多彩的物质组成,物质是由微小的粒子构成的。现有氯化钠、铁、二氧化碳三种物质,二氧化碳由构成,铁由构成,氯化钠由构成。
做铁丝在氧气中燃烧的实验时,把铁丝绕成螺旋状,细铁丝前端系一根火柴,其作用是;实验中可观察到的现象是;集气瓶里预先要装入少量的细沙或水,原因是。反应的文字表达式为。
利用所给的物质写出下列反应的文字或符号表达式。(红磷、石蜡、氧气、氯酸钾、二氧化锰、过氧化氢)
(1)红色固体燃烧产生大量的白烟
(2)是氧化反应但不是化合反应
(3)常温下制取氧气
(4)加热混合物制取氧气
大蒜是人们生活中常见的食品,同时又有药用的价值。大蒜中大蒜新素的化学式为C6H10S2,试计算:
(1)它的相对分子质量是,
(2)大蒜新素中C、H、S三种元素的原子个数比为,
⑶大蒜新素中C、H、S三种元素的质量比为。
(结果保留至0.1%)