实验室有一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2SO”字样(如图所示)。已知固体M只可能是Na2SO3或Na2SO4。若取少量固体M配成溶液,下列试剂不能用于鉴定M的是
| A.Ba(OH)2 | B.稀盐酸 | C.稀硫酸 | D.浓硝酸 |
一定条件下,将A、B、C三种物质各1mol通入一个密闭容器中发生反应:2A(g)+B(g) 2C(g),达到平衡时,B的物质的量可能是
2C(g),达到平衡时,B的物质的量可能是
A.1.5mol B.1mol C.0.5mol D.0
在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g) 2HI(g)。已知H2和I2的起始浓度均为0.10mol·L-1,达平衡时HI的浓度为0.16 mol·L-1,若H2和I2的起始浓度均为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是
2HI(g)。已知H2和I2的起始浓度均为0.10mol·L-1,达平衡时HI的浓度为0.16 mol·L-1,若H2和I2的起始浓度均为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是
| A.0.02 | B.0.04 | C.0.08 | D.0.16 |
在密闭容器中,反应:CH4(g)+H2O(g) CO(g)+3H2(g)△H>0达到平衡。下列叙述不正确的是
CO(g)+3H2(g)△H>0达到平衡。下列叙述不正确的是
| A.增加甲烷的量,上式中△H增大 | B.增大水蒸气的量,可提高甲烷的转化率 |
| C.升高温度,逆反应速率增大 | D.增大体系压强,该反应的化学平衡常数不变 |
把0.6molX气体和0.2molY气体混合于2L容器中,使它们发生如下反应 3X(g)+Y(g)= nZ(g)+2W(g)5min末已生成0.2 mol W,若测知以浓度变化表示Z的反应平均速率为0.01 mol·L-1·min-1 ,则上述反应中的n值是
| A.1 | B.2 | C.3 | D.4 |
下图所示为800 ℃ 时,A、B、C三种气体在密闭容器中反应时浓度的变化,从图像上分析不能得出的结论是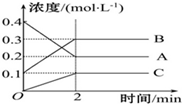
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A (g) 2 B(g) + C(g)
2 B(g) + C(g)