在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,有反应: CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol测得n(N2)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol测得n(N2)随时间变化数据如下表:
| 温度 |
时间/min n/mol |
0 |
10 |
20 |
40 |
50 |
| T1 |
n(N2) |
0 |
0.20 |
0.25 |
0.40 |
0.40 |
| T2 |
n(N2) |
0 |
0.25 |
…… |
0.30 |
0.30 |
下列说法不正确的是
A.0~10 min内,T1时V(N2)的平均反应速率比T2时的平均反应速率小
B.T1<T2
C.a < 0
D.在温度为T2时,向平衡后的容器中再充入1.2mol CH4,重新达平衡时n(N2)=0.40mol
下列指定反应的离子方程式正确的是
| A.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B.试剂瓶玻璃塞被烧碱溶液腐蚀:SiO2 + 2Na+ +2OH-=Na2SiO3↓+ H2O |
| C.向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
对于可逆反应:2AB3(g) A2(g)+3B2(g)(正反应吸热)下列图像正确的是
A2(g)+3B2(g)(正反应吸热)下列图像正确的是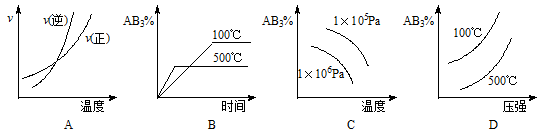
下列有关化学用语表示正确的是
A.CH4分子的球棍模型: |
B.Cl-离子的结构示意图: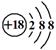 |
C.氟化钠的电子式: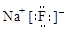 |
D.中子数为146、质子数为92 的铀原子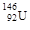 |
足量的铁与一定量的稀硫酸充分反应,共收集到标准状况下气体为3.36 L,则参加反应的铁的质量为
| A.5.6 g | B.8.4 g | C.11.2 g | D.无法计算 |
下列有关物质性质的比较中,正确的是
①热稳定性:CH4>NH3>H2O;②还原性:I->Br->Cl-;③碱性:NaOH>Mg(OH)2>Al(OH)3;
④物质的熔点:O2>Na>Si
| A.①③ | B.②④ | C.②③ | D.①④ |