恒温恒容条件下能够说明可逆反应p(g)+Q(g) ⇋S(g)+R(g)已达平衡的是
| A.容器里P、Q 、R、S四种物质共存 |
| B.容器里Q 、R的体积分数不再改变 |
| C.容器内气体压强、密度不随时间变化 |
| D.单位时间内生成n molP同时消耗n mol S |
下列反应中,属于吸热反应的是
| A.木炭在空气中燃烧 |
| B.氢气在氯气中燃烧 |
| C.盐酸和氢氧化钠溶液反应 |
| D.将Ba(OH)2·8H2O晶体和NH4C1晶体研细后混合并搅拌 |
已知反应:2H2O2=2H2O+O2↑,下列条件下,反应速率最大的是
| A.10℃,5mL 3 %H2O2溶液 | B.10℃,5mL 5 %H2O2溶液 |
| C.39℃,5mL 5%H2O2溶液 | D.30℃,5mL 5 %H2O2溶液且加入少量MnO2 |
下列物质中,常用于在玻璃上刻蚀花纹的是
| A.稀硫酸(H2SO4) | B.氢氧化钠(NaOH)溶液 |
| C.氢氟酸 (HF) | D.碳酸钠(Na2CO3)溶液 |
下列装置中,可用于实验室制取氨气的是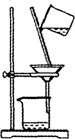
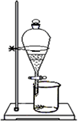
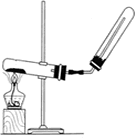
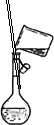
A B C D
烧杯中盛有下列物质,敞口放置一段时间后,溶液质量会增加的是
| A.浓盐酸 | B.浓硫酸 | C.浓硝酸 | D.浓醋酸 |