下列溶液中有关微粒的物质的量浓度关系正确的是
| A.CH3COONa和NaCl的混合溶液中:c(Na+)= c(CH3COO-)+ c(CH3COOH) + c(Cl-) |
| B.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系不可能为c(Cl-) > c(H+) > c(NH4+)>c(OH一) |
| C.0.1 mol·L-1的NaHCO3溶液中: c(Na+)>c(HCO3-) >c(CO32-) >c (H2CO3) |
| D.常温下,等物质的量浓度的三种溶液:①NH4Cl②CH3COONH4 ③NH4HSO4中c(NH4+):②<③<① |
已知25 ℃时, AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,;一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液 |
| D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度小于AgI |
在水电离出的c(H+)=1×10-12mol/L的溶液中,一定能大量共存的离子组是
| A.Al3+、NH4+、SO42-、Cl- | B.Na+、K+、CO32-、SO42- |
| C.K+、 Fe2+、Cl-、NO3- | D.Na+、Ba2+、Cl-、NO3- |
在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应

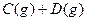 已达平衡的是
已达平衡的是
| A.混合气体的压强 | B.混合气体的平均相对分子质量 |
| C.A的物质的量浓度 | D.气体的总物质的量 |
下列实验事实不能证明醋酸是弱酸的是
| A.常温下,测得醋酸钠溶液的pH>7 |
| B.常温下,测得0.1mol/L醋酸溶液的pH=4 |
| C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 |
| D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和 |
下列过程或现象与盐类水解无关的是
| A.纯碱溶液去油污 |
| B.加热稀醋酸溶液其pH 稍有减小 |
| C.小苏打溶液与AlCl3溶液混合产生气体和沉淀 |
| D.浓的硫化钠溶液有臭味 |