滴定操作过程中,眼睛应注视 ;
判断达到滴定终点的依据为 。
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。 完成下列填空:
(1) Se的原子序数为34,元素Se在元素周期表中的位置为____________________
(2) Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式______________________;生成1 molSeO2转移的电子数为__________NA。
(3) 已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O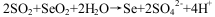
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________________。
(4) 回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3=Na2S4O6+2NaI
配平方程式①,并用单线桥标出电子转移的方向和数目_ ____。
(5) 实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为 。
铝、铁及其化合物在国民经济、日常生活中占有非常重要的地位。请回答下列问题:
(1)铝在自然界中以 态(填“游离”或“化合”)存在;铁的氧化物中常用作红色油漆和涂料的是 (填化学式),该氧化物与铝粉在高温下反应的化学方程式为 ;
(2)用离子方程式表示除去铁粉中混有的铝粉 ;
(3)下列对Fe2+的检验方法不合理的是 。
| A.向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+ |
| B.向某溶液中通入Cl2,然后再加入KSCN溶液变成血红色,说明原溶液中含有Fe2+ |
| C.向某溶液中加NaOH溶液得白色沉淀,再逐渐变为红褐色,说明该溶液中含有Fe2+ |
| D.向某溶液中滴入酸性高锰酸钾溶液,溶液紫红色褪去,说明该溶液中含有Fe2+ |
A、B、C、D四种短周期元素,A元素的一种同素异形体是自然界硬度最大的单质,C与A同主族,C元素的原子序数是B的2倍,工业上以D元素的单质与石灰乳为原料制造漂白粉。按要求回答下列问题:
(1)B的原子结构示意图为 ;镁条在气体B中燃烧生成的物质是 (填化学式);
(2)A的非金属性强于C,请用一个化学反应方程式表示___________ ;
(3)元素B、D形成的化合物BD3能与水反应生成具有漂白性的物质X,写出该反应的化学方程式 。
(8分)取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体。将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀。另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如下图所示。试回答下列问题:
(1)加入盐酸后总共产生的气体在标准状况下的体积为__________________L;
(2)盐酸中HCl的物质的量浓度__________________;
(3)反应后的固体的成分(填化学式)__________________;
(4)x=_____________。
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| W |
X |
Y |
Z |
|
| 结构 或性质 |
最高价氧化物对应的水 化物与其气态氢化物反 应得到离子化合物 |
焰色反应呈黄色 |
在同周期主族元素形成的简单离子中,离子半径最小 |
最高正价与最 低负价之和为6 |
(1)W元素和氢可形成离子化合物,其电子式为 。
(2)Y元素和Z元素可形成YZ3化合物,可用于净水剂,净水原理 (用离子方程式表示)。
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号)。
a.最高价氧化物的水化物的碱性 b.相应硫酸盐水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②由X、Y、氢、氧四种元素所组成的化合物,能与盐酸以1:4反应生成两种常见盐和水,则该化合物的化学式为 。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,混合后溶液中离子浓度由大到小的顺序是 。