钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能 ;
(2)某钢铁厂每天消耗5000t含氧化铁80%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是多少?
II.实验探究炼铁原理某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4  CO↑+ CO2↑+ H2O。
CO↑+ CO2↑+ H2O。
②NaOH溶液可以吸收二氧化碳,反应方程式为:2NaOH+CO2=Na2CO3+H2O
③常温下,Ca(OH)2微溶于水;于是他设计了下图的实验装置,结合装置回答下列问题:
(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择下图中的 (填装置编号);
(2)图中装置C、D的作用分别是 、 ;
(3)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的澄清石灰水,该反应的化学方程式为 ;
(4)该装置设计有一个明显缺陷,你认为是 。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当E中固体全部变黑后,继续通入CO直到玻璃管冷却。将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
查阅资料:a.铁的氧化物在足量的稀盐酸中均能全部溶解。
b.Fe2O3与CO反应的固体生成物可能情况如下:
根据“无气泡”猜想,黑色粉末可能是:①Fe3O4;② ③ 。
(6)定量分析 用电子天平称量得部分数据如下:
| |
玻璃管质 |
玻璃管及其中固体的质量 |
装置F及其中物质的总质量 |
| 反应前 |
28.20 g |
33.00 g |
300.0 g |
| 反应后 |
32.84 g |
300.4 g |
根据上述数据,请选择有效的数据,推断出反应后黑色固体的成分。(写出计算过程)
用化学用语填空:
①空气中含量最多的气体是②两个氧原子
③钠离子④两个二氧化碳分子
(本题7分)某校化学兴趣小组经查阅资料得知:铝是重要的轻金属,广泛应用于航空、电讯和建筑等领域。铝也有其特殊的性质:①铝的熔点是660℃,氧化铝的熔点高达2054℃。②铝虽比锌活泼,但是将铝和锌分别投入稀硫酸中,铝比锌反应慢得多。③尽管铝表面致密的氧化膜能使铝与其周围的介质(空气、水)隔绝,但“奇怪”的是铝制容器仍不能用来盛放和腌制咸菜。为此该小组进行了“铝表面氧化膜”的探究实验,其过程如下,请完成填空:
【实验1】用坩埚钳夹住一块擦去氧化膜的铝片,放在酒精灯火焰上灼烧,铝片表面接触火焰的部分变暗片刻后变软;轻轻摇动,会左右摇晃,却不像蜡烛那样滴落。
(1)请写出在空气中灼烧铝片的化学方程式;
(2)铝片接触火焰的部分不像蜡烛那样滴落的原因是。
【实验2】取2条未用砂纸打磨过的铝片,一片浸入CuCl2稀溶液中,其表面很快析出较多红色粉末状固体;而另一片浸入CuSO4稀溶液中现象一直不明显。
问题:试猜测产生这种现象差异的因素是
【实验3】用砂纸打磨一铝片使其表面较粗糙,再将其放入CuSO4稀溶液中,直到2-3分钟后,铝片表面才有少量红色固体附着。
问题:试写出铝片表面附着红色固体的化学方程式:;
【实验4】向实验2的CuSO4稀溶液中滴入3-5滴NaCl稀溶液,铝片表面逐渐有红色固体析出。
【实验5】向实验2的CuSO4稀溶液中滴入3-5滴Na2SO4稀溶液,铝片表面现象一直不明显。
问题:根据实验2、3、4、5的现象可以得出的结论是
(本题12分)实验室提供下列药品:Na2CO3固体、CaCO3固体、稀H2SO4、稀HCl、和浓HCl;A、B、C、D、E、F、G、H等装置和试管等仪器。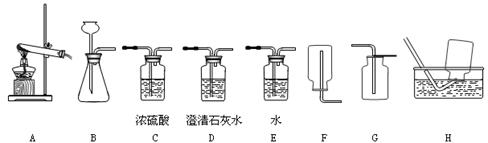
(1)制取CO2的发生装置选,按要求连接好装置后,在装入药品之前必不可少的操作是。制CO2的装置还可以用来制取_________气体,其反应原理是:____________________________(用化学方程式表示)。
(2)检验二氧化碳的方法用化学方程式表示为。
(3)在四支试管中取等量固体和稀硫酸、稀盐酸反应,现象如下表,由此推知,实验室用于制取CO2的药品最合理的是(填序号);反应方程式为:_______________________,
| 反应物 |
①碳酸钙粉末+稀盐酸 |
②碳酸钠+稀硫酸 |
③块状碳酸钙+稀盐酸 |
④碳酸钙+稀硫酸 |
| 现象 |
剧烈,瞬间完成 |
剧烈,瞬间完成 |
有平稳气流产生 |
很慢,稍后停止 |
(4)若要制取干燥的CO2,所有装置的连接顺序为;
(5)若不慎用浓盐酸代替稀盐酸制得了CO2气体,要得到纯净干燥的CO2,所有装置的连接顺序为。
(本题4分)目前市面上有一种新型饭盒“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物。使用时打开隔离层,即发生以下反应:Mg+2H2O=X+H2↑。请根据以上信息回答下列各题:
(1)该饭盒底部“即热”的原理是将能转化为热能;
(2)X的化学式是,你推断X的化学式的依据;
(3)上述化学反应属于(填写基本反应类型)。
(本题3分)下表为某品牌奶粉中标签中的主要营养成分:
| 营养成分 |
蛋白质 (g) |
乳糖 (g) |
脂肪 (g) |
钙 (mg) |
铁 (mg) |
磷 (mg) |
锌 (mg) |
维生素A (国际单位) |
| 每100克含 |
≥22 |
≤50 |
22—26 |
≥1100 |
8—18 |
≥550 |
3—6 |
≥1100 |
(1)上表中未出现六大类营养素中的。
(2)上表出现了种人体所需的微量元素。
(3)人体健康离不开钙元素。下列有关钙元素的叙述中不正确的是。
①幼儿缺钙会得呆小症
②青少年缺钙会得佝偻病和发育不良
③成年人比幼儿和青少年需要摄入更多量的钙
④老年人缺钙会发生骨质疏松,容易骨折