下列关于浓硝酸和浓硫酸的叙述,不正确的是
| A.常温下都能用铝制容器贮存 |
| B.浓硝酸必须保存在棕色试剂瓶中,浓硫酸则不需要 |
| C.常温下都能与铜较快反应 |
| D.露置在空气中,容器内酸液的浓度都降低 |
下列图示的装置属于原电池的是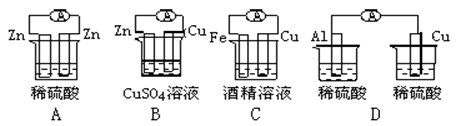
右图是可逆反应X2 + 3Y2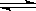 2Z2在反应过程中的反应速率(V)与时(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(V)与时(t)的关系曲线,下列叙述正确的是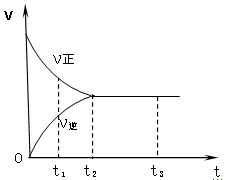
| A.t1时,只有正方向反应 |
| B.t2时,反应到达限度(或平衡) |
| C.t2- t3,反应不再发生 |
| D.t2- t3,各物质的浓度相等 |
一定条件下,反应N2+3H2 2NH3,在2L密闭容器中进行,5min内氨物质的量增加了0.1mol,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨物质的量增加了0.1mol,则反应速率为
| A.v(H2)=0.03mol/(L·min) | B.v(N2)=0.02mol/(L·min) |
| C.v(NH3)=0.1mol/(L·min) | D.v(NH3)=0.01mol/(L·min) |
在碘化钾溶液中加入适量氯水充分反应,并将反应后的溶液分成四份于试管中,编号为I、II、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,下列现象描述正确的是
| A.I中溶液分层.上层无色 | B.Ⅱ中溶液分层,下层紫红色 |
| C.Ⅲ中溶液分层,下层呈棕色 | D.Ⅳ中溶液不分层,溶液由棕色变成黄绿色 |
某碱性溶液中,可以大量共存的离子组是
| A.K+、Na+、HCO3-、NO3- | B.H+、Mg2+、SO42-、NO3- |
| C.Na+、SO42-、Cl-、ClO- | D.Ag+、K+、NO3-、Na+ |