常温下,某溶液中由水电离出的出c(H+)=1.0 ×10—13mol/L则在该溶液中一定不可以大量共存的一组离子是
A.NH4+、NO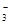 、K+、SO42— 、K+、SO42— |
B.CO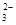 、NO 、NO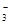 、HCO 、HCO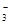 、Na+ 、Na+ |
| C.Na+、ClO—、AlO2—、NO3— | D.MnO4—、K+、Na+、SO42— |
CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是()
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是()
| A.CO全部转化为乙醇 |
| B.正反应和逆反应的化学反应速率均为零 |
| C.CO和H2以1∶2的物质的量之比反应生成乙醇 |
| D.反应体系中乙醇的物质的量浓度不再变化 |
下列关于物质的组成、性质或用途的叙述错误的是()
| A.可燃冰是一种天然气的水合物,它的开采使用有助于解决温室效应 |
| B.乙烯分子中的不饱和碳碳双键比乙烷分子中碳碳单键活泼,易于被加成 |
| C.煤的液化、气化可以提高经济效益,减少酸雨等环境危害的发生 |
| D.工业酒精含95%左右的乙醇,可以用于酒精饮料的勾兑,降低生产成本 |
关于下列图示的说法中正确的是()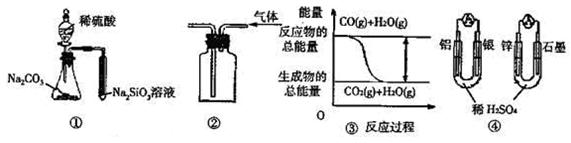
| A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图②所示实验装置排空气法收集CO2气体 |
C.图③表示CO(g)+H2O(g) CO2(g)+H2(g)为吸热反应 CO2(g)+H2(g)为吸热反应 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
如图是甲醇——空气电池工作时的示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。下列说法中正确的是()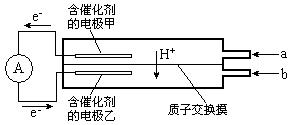
| A.正极反应式为:2H+ +2e— =H2↑ |
| B.乙电极为电池的负极,b处通入的物质是空气 |
| C.负极反应式为:CH3OH+H2O-6e—=CO2+6H+ |
| D.在电池反应中,每消耗l mol氧气,理论上能生成标准状况下CO2气体22.4L |
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是()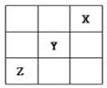
| A.Z一定是活泼的金属元素 |
| B.Y的最高价氧化物的水化物是一种强酸 |
| C.1molX的单质跟足量水反应时,发生转移的电子为2mol |
| D.Y的氢化物稳定性大于Z的氢化物稳定性 |