在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是()
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是()
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L | D.SO3为0.4mol/L |
氢氧化镁在水中存在下列平衡:Mg(OH)2(固)≒ Mg2+ + 2OH-,加入下列物质可使Mg(OH)2固体减少的是()
| A.碳酸钠 | B.硫酸镁 |
| C.硝酸铵 | D.氢氧化钠 |
在一定温度下,可逆反应A(g)+3B(g)≒2C(g)达到平衡的标志是()
A. C的生成速率与C的分解速率相等
B. 单位时间生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
一定条件下,向一带活塞的密闭容器中充入1 mol N2和3mol H2,发生下列反应:N2(g)+3H2(g)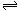 2NH3(g),反应达到平衡后,改变下述条件,NH3气体平衡浓度不改变的是()
2NH3(g),反应达到平衡后,改变下述条件,NH3气体平衡浓度不改变的是()
| A.保持温度和容器压强不变,充入1 mol NH3(g) |
| B.保持温度和容器体积不变,充入1 mol NH3(g) |
| C.保持温度和容器压强不变,充入1 mol N2(g) |
| D.保持温度和容器体积不变,充入1 mol Ar(g) |
E. 保持温度和容器体积不变,充入1 mol H2(g)
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:
Ca(OH)2(s)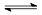 Ca2+(aq)+2OH-(aq)。当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是()
Ca2+(aq)+2OH-(aq)。当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是()
| A.溶液中Ca2+数目减少 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |