下列变化需要加入还原剂才能实现的是
A.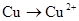 |
B.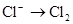 |
C.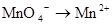 |
D.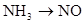 |
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金。关于该电池的叙述正确的是
| A.E为该燃料电池的正极 |
| B.负极发生的电极反应式为ClO—+2e—+H2O=Cl—+2OH— |
| C.电池工作时,正极周围溶液的pH将不断变小 |
| D.镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低 |
已知如下两个热化学反应 (l)+H2(g)→
(l)+H2(g)→ (l)
(l) H>0 ①
H>0 ① (l)+2H2(g)→
(l)+2H2(g)→ (l)
(l) H<0 ②
H<0 ②
下列说法不正确的是
| A.反应①、②都属于加成反应 |
| B.l,3一环己二烯比苯稳定 |
| C.反应①、②的热效应说明苯环中含有的并不是碳碳双键 |
| D.反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.200 mL1 mol Al2(SO4)3溶液中,Al3+和SO42—离子数的总和为NA |
| B.标准状况下,2.24 L乙醇中含有的C—H键数目为0.5NA |
| C.0.1 mol Na完全被氧化生成Na2O2,转移电子的数目为0.1NA |
| D.0.1 mol O2和O3的混合气体中含氧原子数目为0.2NA |
下列反应的离子方程式正确的是
| A.钠和硫酸铜溶液反应:2Na+Cu2+=2Na++Cu |
| B.AlCl3溶液中加入足量的氨水制Al(OH)3:Al3++3OH—=Al(OH)3↓ |
| C.向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3—+OH—=CaCO3↓+H2O |
| D.二氧化硅溶于NaOH溶液:SiO2+2OH—=SiO32—+H2O |
短周期主族元素X、Y、W、Z的原子序数依次增大。其中X、Z同主族,Z的单质是一种良好的半导体材料,W3+与Y2—具有相同的核外电子数。下列叙述正确的是
| A.Y2—的离子半径大于W3+的离子半径 |
| B.Y、Z形成的化合物为离子化合物 |
| C.Z的最高价氧化物对应的水化物的酸性比X的强 |
| D.X的气态简单氢化物的稳定性比Y的强 |