下列关于Na2CO3和NaHCO3的说法中,不正确的是
| A.均为白色固体 | B.受热均易分解 |
| C.其水溶液均显碱性 | D.均能与硫酸反应 |
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) 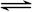 2XY3(g)△H=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g)△H=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热 23.15 kJ |
| ② |
0.6 |
1.8 |
0.8 |
Q(Q>0) |
下列叙述不正确的是()
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为Q
C.达到平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
下列说法正确的是()
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
| A.①③⑤ | B.②④⑥ | C.②③④ | D.①③⑥ |
下列各表述与示意图一致的是()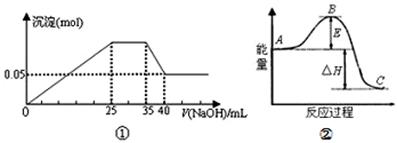
| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH体积的关系图。则:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 |
| B.图①中使用的NaOH的物质的量浓度为1 mol/L |
| C.图②中曲线表示某反应过程的能量变化。若使用催化剂,B点会降低 |
| D.图②中物质A反应生成物质C,△H>0 |
下列各组离子在碱性条件下能大量共存,而在强酸性条件下也能发生氧化还原反应的是
| A.Mg2+、Na+、SO42-、Cl- | B.K+、CO32-、Cl-、NO3- |
| C.Na+、K+、NO3-、SO32- | D.NH4+、Na+、SO42-、NO3- |
下列依据热化学方程式得出的结论正确的是()
A.已知2H2(g)+O2(g) 2H2O(g) ΔH =-483.6 kJ·mol–1,则氢气的燃烧热为241.8 kJ·mol–1 2H2O(g) ΔH =-483.6 kJ·mol–1,则氢气的燃烧热为241.8 kJ·mol–1 |
B.已知C(石墨,s) C(金刚石,s) ΔH>0,则石墨比金刚石稳定 C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
C.已知OH–(aq)+H+(aq) H2O(l) ΔH=-57.4 kJ·mol–1,则含20.0 g NaOH的稀溶液与CH3COOH的稀溶液完全中和,放出的热量等于28.7 kJ H2O(l) ΔH=-57.4 kJ·mol–1,则含20.0 g NaOH的稀溶液与CH3COOH的稀溶液完全中和,放出的热量等于28.7 kJ |
D.已知2C(s)+2O2(g) 2CO2(g) ΔH1 2C(s)+O2(g) 2CO2(g) ΔH1 2C(s)+O2(g) 2CO(g) ΔH2,则ΔH1>ΔH2 2CO(g) ΔH2,则ΔH1>ΔH2 |