解释下列事实的离子方程式不正确的是
A.Cu与浓H2SO4反应放出气体: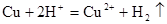 |
B.用大理石与稀盐酸制备CO2: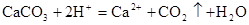 |
C.稀H2SO4与BaCl2溶液反应生成沉淀: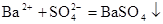 |
D.盛放NaOH溶液的试剂瓶不能用玻璃塞: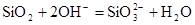 |
“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中,“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将纳米材料分散到液体分散剂中,所得混合物可能具有的性质是
| A.得到均一稳定的溶液 | B.得到浑浊的液体 |
| C.能全部透过半透膜 | D.有丁达尔现象 |
下列反应中二氧化硫是被还原的是
| A.SO2+2H2O+Cl2=H2SO4+2HCl | B.SO2+H2S=2H2O+3S↓ |
| C.SO2+2NaOH=Na2SO3+H2O | D.SO2+Na2CO3=Na2SO3+CO2 |
有Na2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的物质的量浓度为0.4 mol/L,SO42-的物质的量浓度为0.7 mol/L,则此溶液中Na+的物质的量浓度为
| A.0.1 mol/L | B.0.15 mol/L | C.0.2 mol/L | D.0.25 mol/L |
|
为了配制100 mL 1 mol·L-1的NaOH溶液,其中有下列几个操作:①NaOH固体放在纸上进行称量 ②选刚用蒸馏水洗净的100 mL容量瓶进行配制 ③NaOH在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中 ④用蒸馏水洗涤烧杯内壁2次,洗涤液也均转入容量瓶中 ⑤使蒸馏水沿玻璃棒注入容量瓶,直到溶液的凹液面恰好与刻度线相切。其中操作错误的是
A.①②③ B.③④⑤4℃时水的密度为1g/mL,若20滴水恰好1 mL,那么1滴水中所含的水分子数约为(NA表示阿伏加德罗常数的值)
| A.20NA | B.NA/360 | C.9 NA/10 | D.360/NA |