将氨水逐渐加入到物质的量浓度相等的AlCl3和MgCl2的混合溶液中至过量,生成沉淀的物质的量和所加氨水的体积的关系如下图,正确的是()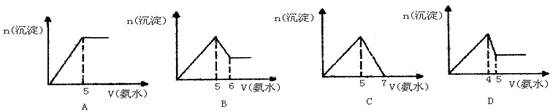
右图为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3个,下说法中不正确的是()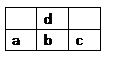
| A.原子半径大小顺序是c>b>d>a |
| B.d的氢化物比a的氢化物稳定 |
| C.a和d的原子结合可以形成带3个负电荷的阴离子 |
| D.a、b、c最高价氧化物对应水化物的酸性强弱关系是c>b>a |
已知元素的原子序数,可以推断原子的()
①质子数;②中子数;③最外层电子数;
④核电荷数;⑤核外电子总数;⑥相对原子质量
| A.①③④⑤ | B.①②④⑤ | C.①④⑤⑥ | D.①②③⑤ |
图为元素周期表的一部分(数字为原子序数),其中X元素的原子序数为35的是()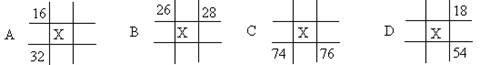
某有机物在氧气中充分燃烧,只生成水蒸气和二氧化碳,且两者物质的量之比为1:1,由此可以得出的结论是()
A.可以推算出该有机物的化学式 B.分子中C、H原子个数之比为1:2
C.分子中C、H原子个数之比为1:1 D.分子中必定含氧原子