在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
| A.Na+、K+、ClO-、Cl- | B.Mg2+、Na+、SO42-、Cl- |
| C.Ca2+、HCO3-、NO3-、K+ | D.Na+、Cu2+、SO42-、NO3- |
下列离子或分子的水溶液组合中,能大量共存的是()
| A.SO42-、S2-、OH-、Na+ | B.NH3·H2O、K+、Ag+、NO3- |
| C.CH3CHO、H2O、Na+、NH4+ | D.Cr2O72-、Mg2+、SO42-、CH3CH2OH |
设NA为阿伏加德罗常数的值,下列叙述一定正确的是()
| A.常温下,0.1mol/L的NH4NO3溶液中氮原子数为0.2 NA |
| B.1 mol羟基中电子数为10 NA |
| C.在12g石墨片层结构中,含有六元环的个数为0.5 NA |
| D.22.4 L乙烯中C-H键数为4 NA |
2011年3月11日14时46分,日本发生9.0级的强震并引发海啸和核泄露,下列说法正确的是()
| A.日本发生的强震并引发核泄露给我们的启示是人类不能发展核能 |
B.服用 含放射性物质超标的水和食物,不会对人体产生危害 含放射性物质超标的水和食物,不会对人体产生危害 |
C.核反应堆中的235U被中子轰击后,产生新的原子,该变化为化学变 化 化 |
| D.核泄露中的垃圾水大量流入海洋,会引发海产品污染 |
向5mL 0.2 mol/L的盐酸中加入5mL0.18 mol/L AgNO3溶液生成沉淀,则生成沉淀后溶液中Ag+的物质的量浓度为(已知 Ksp(AgCl)=1.8×10-10)
| A.1.8×10-6mol/L | B.1.8×10-7mol/L |
| C.1.8×10-8mol/L | D.不存在 |
在甲、乙两个密闭容器中发生如下反应:2A(g)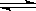 B(g) + 2C(g) ΔH=" m" kJ/mol,有下列两种图像。有关叙述正确的是
B(g) + 2C(g) ΔH=" m" kJ/mol,有下列两种图像。有关叙述正确的是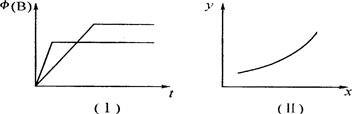
| A.若甲为恒容体系,图像(Ⅰ)代表温度不同时,时间与B的体积分数关系图,则m>0 |
| B.恒温条件下,图像(Ⅰ)可能代表压强不同时,时间与B的体积分数关系图 |
| C.恒温条件下,若乙容器存在图像(Ⅱ)关系,则当x代表压强时,y一定代表B的体积分数 |
| D.恒温条件下,若甲、乙两容器体积相同,起始时分别向甲中充人2 mol A,乙中充入1 molB,3 mol C,则达平衡后两容器中B的体积分数一定相同 |