在如图的实验装置中,实验开始一段时间后,对看到的现象叙述不正确的是
下列分子或离子中,含有孤对电子的是( )
| A.NH4+ | B.CO2 | C.SiH4 | D.CH4 |
下列物质中,含极性键和非极性键且分子有极性的是( )
| A.乙烯 | B.H2O2 | C.甲烷 | D.三氯甲烷 |
将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,将溶液在HCl气氛中小心蒸干得固体W2 g。下列所列关系式中正确的是
| A.35.5a=(W2-W1)V2 | B.n(Al)>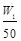 mol mol |
C.n(Na)+3n(Al)= mol mol |
D. aV2=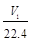 |
在25℃时,AgX、AgY、AgZ均难溶于水,且Ksp(AgX) = 1.8×10-10,Ksp(AgY) = 1.0×10-12,Ksp(AgZ) = 8.7×10-17。下列说法(均在25℃)错误的是
| A.三种饱和溶液中溶质的物质的量浓度的大小顺序为c(AgX)>c(AgY)>c(AgZ) |
| B.若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)减少 |
| C.若取0.188g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为1.0×10-2mol·L-1 |
| D.往C选项的溶液中加入1 mL 0.1mol·L-1的NaZ溶液,能生成AgZ沉淀 |
某溶液中含有较多的Na2SO4和少量的 Fe2(SO4)3。若用该溶液制取芒硝(Na2SO4·10H2O),可供选择的操作有:①加适量H2SO4溶液;②加金属钠;③结晶;④加过量NaOH;⑤加强热脱结晶水;⑥过滤。正确的操作步骤是
| A.②⑥③ | B.④⑥①③ | C.④⑥③⑤ | D.②⑥①③⑤ |