Ⅰ、现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸 式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨三角漏斗;胶头滴管。有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液;⑤蒸馏水。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是
(2)配制250mL0.1000mol/LNaOH溶液时,还缺少的仪器是 。
(3)过滤时,应选用上述玻璃仪器中的 (填编号)
Ⅱ、为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在 (填“酸式滴定管”或“碱式滴定管”)中,达到滴定终点的现象为 。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ _ (填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为 mol/L。
如图为实验室制取蒸馏水的装置示意图。请根据图示回答下列问题: v
v
⑴图中两处明显的错误是:
,。
⑵ A仪器的名称是,B仪器的名称是。
⑶实验时A中除加入适量自来水外,还需加入少量,其作用是。
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗 盐的提纯”及你做过的该实验回答下列问题。
盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①停止加热;②固定铁圈位置 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④放置酒精 灯; ⑤加热搅拌;。其正确的操作顺序为。
灯; ⑤加热搅拌;。其正确的操作顺序为。
(2)在粗盐提纯过程中,如何检验NaCl溶液中SO42-是否除尽?。如果还有,应该如何除去SO42-离子?。
(3)在粗盐提纯的过程中需要滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的。
实验室需用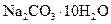 晶体配制500mL0.05mol/L的
晶体配制500mL0.05mol/L的 溶液,请回答下列问题:
溶液,请回答下列问题:
(1)应用托盘天平称取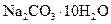 晶体_______g。
晶体_______g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1g以下使用游码),天平平衡时,实际称量的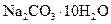 晶体是__________g。
晶体是__________g。
(3)本实验用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、________、________。
(4)以下情况会使所配溶液的浓度产生何种影响(填“偏高”、“ 偏低”、“不变”。):
偏低”、“不变”。):
a.溶解晶体用的烧杯和玻璃棒未洗涤。____________
b.定容时俯视刻度线。____________
c.所用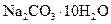 晶体已失去部分结晶水。____________
晶体已失去部分结晶水。____________
某学生用已知物质的量浓度的盐酸测定未知物质的/量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1用标准的盐酸滴定待测的NaOH溶液时:左手_______________________,右手_____________________眼睛注视__________________________________直到因加入一滴盐酸后,溶液由黄色变______色,并且_____________________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是()
A:酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B:滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C:酸式滴定管在滴定前有气泡 ,滴定后气泡消失
,滴定后气泡消失
D:读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL终点读数为_______mL,所用盐酸溶液的体积为_________mL
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积 |
0.1000mol/L盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度:____________________________
现用98%的浓H2SO4(ρ=1.84g/cm3)配制浓度为0.5mol/L的稀硫酸500mL。
(1)选用的主要仪器有:烧杯、量筒、玻璃棒、、
(2)请将下列操作按正确的顺序把序号填在横线上:
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.定容,最后用胶头滴管加水至刻度 |
| D.洗涤所用仪器并将洗涤液一并转入容量瓶 |
E.稀释浓H2SO4
F.冷却后将溶液转入容量瓶
(3)简要回答下列问题:
①所需浓H2SO4的体积为mL。
②洗涤烧杯2~3次,洗液没有转入容量瓶,会使最终结果;定容时必须使溶液
凹液面最低处与 刻度相切,若俯视会使结果。(以上填“偏高”、“偏低”或“无
刻度相切,若俯视会使结果。(以上填“偏高”、“偏低”或“无
影响”)