(8分)下面是几种实验室制取气体的发生装置与收集装置。
(1)写出仪器名称:Ⅰ ,Ⅱ 。
(2)实验室可用双氧水与二氧化锰制取氧气。若要较好地控制产生氧气的速度,应选用装置 (填编号)。该变化所涉及的物质中,氧元素的化合价为-1价的物质是 (填化学式)。
(3)实验室还可以用氯酸钾和二氧化锰制氧气,反应的化学方程式为: ,其中二氧化锰在化学反应前后固体混合物中的质量分数将 。(填“变大”、“变小”或“不变”)
(4)D装置收集氧气,操作的正确顺序为 (填编号)。
①将导管伸入集气瓶口,气体进入瓶中
②将装满水的集气瓶倒置在水槽中
③当气体收集满时,用毛玻璃片盖上瓶口,将集气瓶移出水面放置
若用E装置进行排空法收集氧气,气体应从 (填“a”或“b”)端通入。
请你用所学的化学知识结合生活经验回答下列问题
(1)衣服上的油污,可以用汽油洗净,其原理是;也可以用加了洗涤剂的水洗净,其原理是。
(2)苹果被切开的切面放置一段时间会“生锈”,其原因是。
(3)茶杯内的纱网可将茶叶与茶水分离,便于饮用,利用的原理是。
(4)盛放石灰水的瓶内壁“白膜”形成的原因是。(用化学方程式回答)
根据下图回答问题。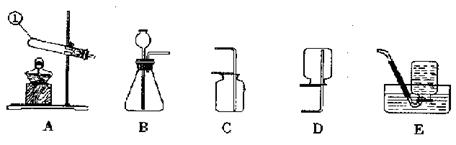
(1)写出标有序号的仪器名称:①____________。
(2)用高锰酸钾制取氧气的化学方程式为________________________,应选用的发生装置为____,(填序号,下同),收集装置为______。
(3)实验室制取二氧化碳应选用的发生装置为_____,二氧化碳的验满方法是
。
下表是XX汽水的配料标签内容,按要求回答相关问题:
(1)由该标签内容可知“XX汽水”中溶解的气体是,其检验方法是。标签中的“注意:禁止加热,避免阳光直晒及高温”内容说明气体的溶解度随温度的升高而。
(2)为检验XX汽水中是否含有柠檬酸,进行了如下实验:
取少量汽水于试管中,滴加2-3滴紫色石蕊试液,发现紫色石蕊试液变为红色,某同学据此认为汽水中含有柠檬酸,该同学判断的依据是:。另一位同学认为上述实验还不足以证明汽水中含有柠檬酸。其质疑的理由是:。
(3)你验证汽水中含有柠檬酸的方法是。
小资料: 1. 紫色石蕊试液是一种酸碱指示剂,遇酸性物质变为红色。
2.柠檬酸是一种有机酸。
向装有等量水的A、B、C烧杯中分别加入10g、20g、25g硝酸钾固体,充分溶解后,现象如图一所示。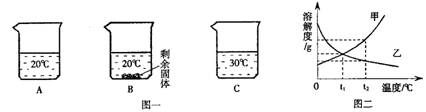
(1)烧杯A中溶液的溶剂是。
(2)烧杯A、B、C中的溶液一定属于饱和溶液的是(填序号)。
(3)图二能表示硝酸钾溶解度曲线的是(填“甲”或“乙”)。
(4)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的(填序号)。
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙D.溶质质量分数:甲>乙
化学是从分子、原子的视角认识物质的,请按要求回答问题:
(1)用化学用语书写:①干冰②两个铁原子③三个氧分子 (2)依据图示回答:图A~C是分子的微观示意图,其中“”表示氢原子,“○”表示氧原子。
(2)依据图示回答:图A~C是分子的微观示意图,其中“”表示氢原子,“○”表示氧原子。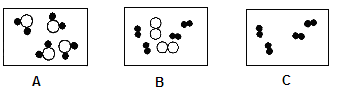
①表示化合物的是图_____,图C中物质的化学式是__________。
②可表示A转变为B的化学方程式是_________________,它属于基本反应类型中的__________反应。