(6分)某同学设计下图所示的实验装置,进行一氧化碳还原氧化铁的实验。试回答: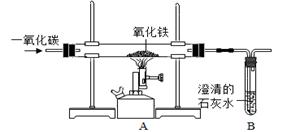
(1)该装置存在的一个主要问题是 ,你的改进方法是 。
(2)实验过程中图A处玻璃管中能观察到的实验现象是 ,发生反应的化学方程式为 。
(3)B处观察到的实验现象是 。该同学实验完成后,发现过量的澄清石灰水增重0.44g,则通入装置的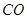 气体质量 (填“>”、“<”或“=”)0.28g。
气体质量 (填“>”、“<”或“=”)0.28g。
(6分)我国新修订的《环境保护法》已于2015年1月1日起施行,体现了加强生态文明建设的新要求。
(1)①近期许多城市出现雾霾天气,形成雾霾是空气中PM2.5含量的增加。PM2.5指的是
a.SO2b.CO c.NO2 d.可吸入颗粒物
②治理被酸雨侵蚀的酸性土壤,可加入适量的(填字母)。
a.KClb.Ca(OH)2c.SiO2
(2)目前,人类以化石燃料为主要能源,常见的化石燃料包括煤、石油和,该物质主要成分燃烧的化学方程式是。
(3)二氧化氯(ClO2)是新一代饮用水的消毒剂,工业上将氯气(Cl2)通入亚氯酸钠(NaClO2)溶液中反应来制取二氧化氯,同时生成氯化钠。写出该反应的化学方程式:。
(8分) 完成下列变化的化学方程式。
(1)实验室加热高锰酸钾制取氧气:;
(2)用含氢氧化铝的胃舒平治疗胃酸过多:;
(3)向硫酸铜溶液中加入氢氧化钠溶液:;
(4)少量硫酸铵固体与氢氧化钠固体混合研磨:;
(6分)芬兰发明家马蒂·努尔米亚发明了一种中和处理二氧化碳的新方法,是将二氧化碳从火力发电厂的烟气中分离出来,放入含有长石成分的水溶液里进行中和处理。在反应过程中,长石的成分不仅能吸收二氧化碳,同时还会生成一些有用的副产品,这些副产品可用作生产铝的原材料和玻璃制造业。其主要流程可示意如下:
(1)发明家将CO2从火力发电厂的烟气中分离出来,通入含有长石的水溶液里吸收,从环保的角度看,这样做的意义是;
(2)长石是地壳中最常见的矿石,含量高达60%。长石主要包括钾长石 、钠长石
、钠长石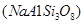 、钙长石(
、钙长石( )。若钙长石吸收
)。若钙长石吸收 的反应方程式为:
的反应方程式为:
请模仿钙长石,写出钠长石吸收CO2的化学反应方程式;
(3)若A的pH小于7,试写出一个符合反应②的化学方程式;
(4)溶液M中的溶质为,B可用作改良酸性土壤,则B为 _;操作③主要目的为。
(9分)现有下列装置,回答问题: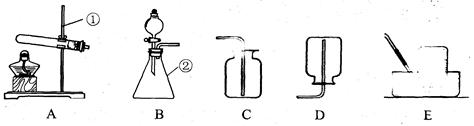
(1)写出有标号仪器的名称:①,②;
(2)实验室用双氧水和二氧化锰制取氧气的化学方程式为,发生装置为 (填字母序号)。若反应过于剧烈,从实验安全角度考虑,可以采取的措施有(写一种即可);
(3)实验室用高锰酸钾制取氧气,为进一步研究高锰酸钾的分解产物,某兴趣小组查阅资料,并取一定质量的高锰酸钾加热使之完全分解,进行下表所示的实验。
【实验内容】:
| 编号 |
实验内容 |
实验现象 |
实验结论 |
| 1 |
取反应后固体剩余物0.2g 加入5mL6%的 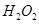 溶液 溶液 |
剧烈反应,放热 产生大量气泡 |
生成物中的 催化分解 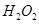 |
| 2 |
取0.2g 加入5mL 加入5mL( 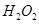 质量分数)的 质量分数)的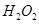 溶液 溶液 |
平稳反应,放热,持续产生气泡 |
 催化 催化分解 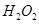 |
| 3 |
取反应后固体剩余物1.0g,加入足量水,充分溶解,过滤 |
固体完全溶解,滤纸 上无黑色固体残余物 |
固体剩余物中无 |
【实验分析】:
①完善上表中的填空内容:实验2、实验3 ;
②实验2的目的是;
③经讨论,实验1的结论不正确,理由是;
【资料】:在43.9℃~377.9℃范围中,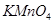 受热分解时,会发生以下两个反应:
受热分解时,会发生以下两个反应:
④取8.0g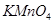 ,加热使之完全分解,生成
,加热使之完全分解,生成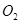 的质量可能为(填字母序号);
的质量可能为(填字母序号);
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,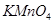 在43.9℃一377.9℃范围中的失重率(
在43.9℃一377.9℃范围中的失重率(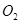 与
与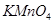 的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中,
的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中,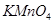 分解反应主要以(填“a”或“b”)为主。
分解反应主要以(填“a”或“b”)为主。
(5分)氯化钠是重要的调味品,是舌尖上最不可缺少的味道。下面三幅示意图分别表示不同的化学反应,但生成物中都有氯化钠。
(1)图1是金属钠与氯气反应生成氯化钠的微观示意图,氯化钠由构成(填微粒符号)。由图1可知,元素的化学性质与原子结构中的(填字母序号)有密切的关系;
A.最外层电子数 B.内层电子数 C.质子数
(2)图2描述了NaOH溶液与盐酸反应的微观实质,图中A、B、C处应填入的化学符号依次为;
(3)图3所示的四种物质中属于氧化物的是(填化学式),请标出NaClO2中氯元素的化合价。