从1L1 mol/L的氯化钾溶液中取出50mL溶液,该50mL氯化钾溶液的物质的量浓度为
| A.0.02 mol/L | B.0.05 mol/L | C.1 mol/L | D.2mol/L |
下列各组物质中属于同位素的是
| A. O2和O3 | B.正丁烷和异丁烷 |
| C.12C和14C | D.Na2O和Na2O2 |
在恒容密闭容器中存在下列平衡:C(s)+H2O(g) CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如图所示。下列说法错误的是
CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如图所示。下列说法错误的是
| A.该反应的ΔH>0 |
| B.若T1、T2时的平衡常数分别为K1、K2,则K1=K2 |
| C.通过加热可以使B点变到C点 |
| D.在T2时若反应进行到状态D,则一定有υ(正) <υ(逆) |
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是:
| 实验 组别 |
反应 温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
| V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
| A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
| B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
| C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
| D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
下列各溶液中,相关微粒物质的量浓度关系不正确的是高
| A.0.1 mol·L-1NH3·H2O溶液中: c (NH4+) < c (OH-) |
| B.0.1 mol·L-1NH4Cl溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| C.0.1 mol·L-1Na2CO3溶液中:c((HCO3-)+c(CO3-)+ c (H2CO3)=" 0.1" mol·L-1 |
| D.浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4、NH4HSO4溶液,c(NH4+)大小顺序:CH3COONH4 > NH4Cl > NH4HSO4 |
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示。下列说法不正确的是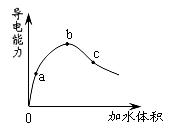
| A.在0点时,醋酸不导电 |
| B.a、b、c三点,a点时醋酸溶液中H+浓度最小 |
| C.b点时,醋酸电离程度最大 |
| D.可通过微热的方法使c点溶液中c(CH3COO-)增大 |