实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出(已知硝酸的还原产物是NH4NO3)。在反应结束后的溶液中,逐滴加入5mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则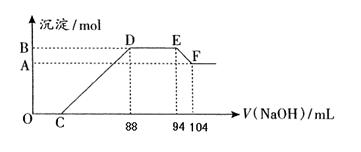
(1)B与A的差值为: mol
(2)DE段生成物的物质的量为: mol。
(3)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为:
(4)写出铝与该浓度硝酸反应的离子方程式:
右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为________ mol·L-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500 ml 物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取______ ml 上述浓盐酸进行配制。
②在配制过程中,下列实验操作对配制的稀盐酸的物质的量浓度偏小的是()
| A.用量筒量取浓盐酸进俯视观察凹液面 |
| B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 |
| C.若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将 |
| D.定容时,眼睛俯视 |
E.未冷却到室温就注入容量瓶定容
③配制过程中,所用到的仪器除烧杯、玻璃棒、量筒外还需 。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:请回答下列问题
(1)写出实验流程中下列物质的化学式:试剂X ,沉淀A 。
(2)按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 。
(3)上述实验流程中加入过量的Na2CO3的目的是____________,确认Na2CO3已过量的实验方法是:___________________________
(4)写出步骤①中发生反应的离子方程式:__________________________________;
(1)现有下列物质 ①Fe、② HCl气体、③NaOH固体、④NH3气体、⑤ KCl溶液、⑥CH3COOH、⑦SO3、⑧乙醇、⑨BaSO4固体请用以上物质回答下列问题。(填序号)电解质: ;非电解质: ;上述状态能导电的是: 。
(2)按要求写出方程式。
①Mg(OH)2和盐酸: (写出离子方程式)
②足量澄清石灰水通入少量CO2: (写出离子方程式)
③Fe2(SO4)3: (写出电离方程式)
④H++OH—=H2O: (写出对应的化学方程式)
⑤CO32—+2H+=CO2↑+H2O: (写出对应的化学方程式)
对乙酰氨基苯酚I( )是最常用的非甾体消炎解热镇痛药,可用如下方法合成:
)是最常用的非甾体消炎解热镇痛药,可用如下方法合成:
请回答下列问题:
(1)A.B.C.D.E中能使酸性高锰酸钾溶液褪色的物质为 (写结构简式),H所含官能团的名称是 ;
(2)①②③④中属于取代反应的是 ;
(3)关于I的说法不正确的是 ___________________________
A.1 mol的I与氢氧化钠反应消耗1 mol氢氧化钠
B.1 mol的I与氢气反应消耗4 mol氢气
C.可与溴水发生加成反应
D.分子中的所有原子共面
(4)写出符合下列条件的D的同分异构体__________
①五元环化合物;②含酯基;③可与金属钠反应产生氢气。
(5)写出反应④的化学方程式: 。
(1)下图是金属镁与卤素反应的能量变化图(反应物和产物均为25 ℃时的稳定状态)。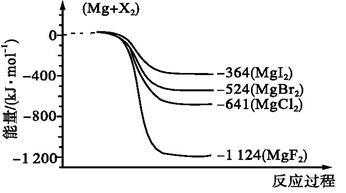
①由图可知Mg与卤素单质的反应均为放热反应,判断依据是 ;推测化合物的热稳定性顺序为MgI2 MgF2(填“>”“=”或“<”)。
②此温度下Mg与氯气生成19 g MgCl2,则产生的热效应为 kJ
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是_______________________________。