(8分,每空1分)兴趣小组的学生根据Mg与CO2反应原理推测Na也能在CO2中燃烧,为了确定其产物并进行实验论证,某同学设计了下列装置进行实验(已知PdCl2能被CO还原得到黑色的Pd)。请回答下列问题: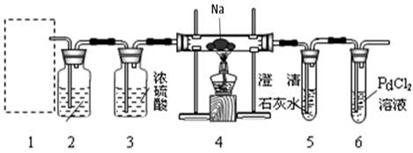
(1)上图装置2中应盛放 溶液。
(2)为了使反应随开随用,随关随停,上图方框内应选用 装置(填下图字母代号)。
(3)检查装置的气密性完好并装好药品后,在点燃酒精灯前,应先进行装置1中的反应操作,待装置 (填数字编号)中出现 现象时,再点酒精灯,这步操作的目的是 。
(4)①若装置6中有黑色沉淀生成,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为 。
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为 。
(5)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳。当确认钠充分反应后,请你设计一个简单实验,验证装置4中的残留固体中是否有碳: 。
Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示: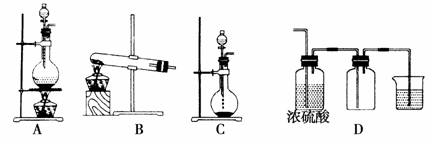
(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为_________________________________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是_______________(填序号,下同)。
①密度②颜色③溶解性 ④热稳定性⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2②NO ③Cl2④H2⑤HCl
其中在D装置中连接小烧杯的目的是____________________。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(1)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;
(2)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
氨的测定装置(已省略加热和夹持装置)
①装置中安全管的作用原理是__________________________________________。
②样品中氨的质量分数表达式为________。
某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示(图中连接胶管、夹持和加热装置省略):
查阅资料可知,HSO3- 的酸性强弱与H2CO3相近。请回答下列问题:
(1)装置A中发生反应的化学方程式是:A
(2)上述装置的接口连接顺序依次是a→→→→→g→h→d(填导管接口字母)。
(3)证明SO2具有氧化性的现象是;证明SO2具有还原性的实验中,反应的离子方程式是。
(4)C试管中NaOH溶液的作用是,CCl4的作用是。
下列关于应用套管实验装置(部分装置未画出)进行的实验,叙述错误的
| A.利用甲装置可以制取少量H2 |
| B.利用乙装置可以验证Na2O2与水反应既生成氧气,又放出热量 |
| C.利用丙装置验证KHCO3和K2CO3的热稳定性,X中应放的物质是K2CO3 |
| D.利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液 |
(12分)如图为实验室制取和收集纯净干燥的氯气,并进行氯气性质探究的实验装置图:
|
下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题:
(1)试管C口部的棉团上(碱过量)发生反应的离子方程式是
(2)反应一段时间后,停止反应,将B试管中的溶液加热,可以观察到。试管C中溶液变浑浊,则证明SO2具有性。
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是,如果浸NaHCO3溶液(过量),则发生反应的化学方程式是。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是(写两种)