2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应PCl3g)+Cl2(g) 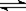 PCl5(g) 达到平衡时,PCl5为0.4mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g) 达到平衡时,PCl5为0.4mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
| A.0.40mol | B.0.20mol |
| C.大于0.20mol,小于0.40mol | D.小于0.20mol |
为探究外界条件对反应:mA(g)+nB(g) cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
| A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大 |
| B.升高温度,正、逆反应速率都增大,平衡常数增大 |
| C.△H>0 m+n>c |
| D.温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小 |
已知某有机物X的结构简式如图所示,下列有关叙述不正确的是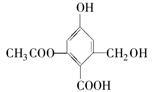
| A.X的化学式为C10H10O6 |
| B.X在一定条件下能与FeCl3溶液发生显色反应 |
| C.1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、5mol、1 mol |
| D.X既可以和乙醇又可以和乙酸发生酯化反应 |
下列分子式表示的有机物中,含单官能团的同分异构体数目最多的是
| A.C4H10O | B.C4H10 | C.C3H6O | D.C4H7Cl |
某羧酸酯的分子式为C19H28O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为
| A.C15H24O5 | B.C15H18O4 | C.C15H20O5 | D.C15H12O5 |
NA代表阿伏加德罗常数。已知C2H4和C3H6的混合物的质量为a g,则该化合物
| A.所含共有电子对数目为(3a/14)NA |
| B.所含碳氢键数目为aNA/14 |
| C.完全燃烧时消耗的O2一定是33.6a/14 L |
| D.所含原子总数为aNA/14 |