一定温度下,密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时测得NH3的物质的量为0.6mol。若在开始时充入2.0 molN2和6.0molH2,则平衡时NH3的物质的量为
| A.若为定容容器,n(NH3)=1.2mol | B.若为定容容器,n(NH3)>1.2mol |
| C.若为定压容器,n(NH3) >1.2mol | D.若为定压容器,n(NH3)<1.2mol |
关于有机物的下列说法正确的是( )
| A.核糖、脱氧核糖、半乳糖、果糖等均为单糖,葡萄糖是最简单的醛糖 |
| B.人造丝、人造棉、醋酸纤维、铜氨纤维、粘胶纤维的主要成分均为纤维素 |
| C.红外光谱仪、核磁共振、质谱仪、原子吸收光谱都可用于有机化合物官能团结构的分析 |
| D.蛋白质的一级结构决定蛋白质的生物活性;蛋白质的二级结构主要依靠肽链—NH—上的氢原子与羰基上的氧原子形成氢键而实现的 |
人类已知的物质中绝大多数是有机物,我们的日常生活也离不开有机物。关于有机物的下列说法中,正确的是( )
| A.两个氨基酸分子间脱去一个水分子能形成二肽。将甘氨酸与丙氨酸的混合物在一定条件下反应,能生成三种二肽 |
| B.醇一定能氧化生成醛或酮,醇与酸反应一定生成酯 |
| C.如果将有机物分子中的一个碳原子被一个氮原子代替,所得有机物的相对分子质量比原物质增大1 |
| D.有机酸酯RCOOR′(R、R′为烃基)在氢氧化钠作用下完全水解时,一定消耗相同物质的量的氢氧化钠 |
1 mol某有机物在稀H2SO4作用下,水解生成2 mol相同的物质。下列物质中: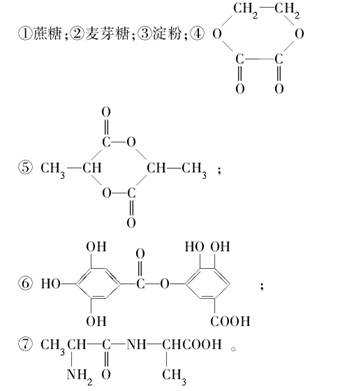
符合题意的物质可能是( )
| A.①②⑤⑦ | B.④⑤⑦ | C.②⑤⑥⑦ | D.①④⑤⑥ |
下列说法正确的是( )
| A.1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 |
| B.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 |
| C.油脂不是高分子化合物,1 mol油脂完全水解生成1 mol甘油和3 mol高级脂肪酸 |
| D.欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2并加热 |
下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是( )
A.淀粉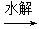 葡萄糖 葡萄糖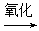 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
B.纤维素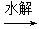 葡萄糖 葡萄糖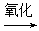 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
C.油脂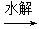 甘油和高级脂肪酸 甘油和高级脂肪酸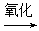 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
D.蛋白质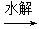 氨基酸 氨基酸 人体所需的蛋白质(人体生长发育) 人体所需的蛋白质(人体生长发育) |