甲醇、乙二醇、丙三醇中分别加入足量的金属钠产生等体积的氢气(相同条件),则上述三种醇的物质的量之比是
| A.2∶3∶6 | B.6∶3∶2 | C.4∶3∶1 | D.3∶2∶1 |
常温下,有下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有关说法正确的是
| A.①、②、④溶液分别与足量铝粉反应,生成H2的量:②最少 |
| B.四种溶液的KW相同,由水电离的c(H+):①=③>②=④ |
| C.将①、④两种溶液混合后,若pH=7,消耗溶液的体积为:①>④ |
| D.向等体积的四种溶液中分别加入1000 mL水后,溶液的pH:③>④>②>① |
常温下,对于醋酸溶液的下列说法中,不正确的是
| A.0.1 mol·L-1的醋酸溶液中加水稀释,溶液中c(OH-)减小 |
| B.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| C.pH=4的醋酸溶液与pH=10的烧碱溶液等体积混合后溶液呈酸性 |
| D.醋酸溶液中加入少量醋酸钾晶体,醋酸电离程度减小 |
下列有关同分异构体和同系物的说法正确的是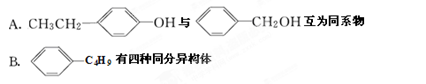
C.式量最小且含手性C原子的烷只有一种同分异构体
D.碳原子总数小于10个的烷烃,一氯代物总数只有一种的有机物一共有4种
燃料电池能量利用率可高达80%,下列有关燃料电池的说法错误的是
| A.燃料电池的负极反应物是氢气、甲烷、乙醇等物质 |
| B.氢氧燃料电池常用于航天飞行器,产物为水经过处理之后可供宇航员使用 |
| C.乙醇燃料电池的电解质常用KOH,负极反应为C2H5OH-12e-=2CO2↑+3H2O |
| D.H2SO4作电解质,甲烷燃料电池的正极反应为O2+4H++4e-=2H2O |
一定条件的密闭容器中:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述不正确的是
4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述不正确的是
| A.达到平衡时放出热量为905.9 kJ,则起始时投入4 mol NH3和5 mol O2 |
| B.平衡时4v正(O2)=5v逆(NO) |
| C.平衡后降压,混合气体平均摩尔质量减小 |
| D.NH3与O2起始时物质的量之比等于4:5,则平衡后两物质的转化率一定相等 |