下列实验的失败原因可能是因为缺少必要的实验步骤造成的是
①将乙醇和乙酸混合,再加入稀硫酸共热制乙酸乙酯
②实验室用无水乙醇和浓硫酸共热到140℃制乙烯
③验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液出现褐色沉淀
④做醛的还原性实验时,当加入新制的氢氧化铜悬浊液后,未出现红色沉淀
⑤检验淀粉已经水解,将淀粉与少量稀硫酸加热一段时间后,加入银氨溶液后未析出银镜
| A.①④⑤ | B.①③④⑤ | C.③④⑤ | D.④⑤ |
在相同温度和压强下,对反应CO2(g)+H2(g) CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 |
H2[来源:] |
CO |
H2O |
|
| 甲 |
amol |
amol |
0mol |
0mol[来 |
| 乙 |
2amol |
amol |
0mol |
0mol |
| 丙 |
0mol |
0mol |
amol |
amol |
| 丁 |
amol |
0mol |
amol |
amol |
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A.乙=丁>丙=甲 B.丁>丙>乙>甲 C.丁>乙>丙=甲 D.乙=丁<甲=丙
一定温度下,可逆反应A2(s)+3B2(g)  2AB3(g)达到平衡的标志是()
2AB3(g)达到平衡的标志是()
| A.容器内每减少1mol A2,同时生成2mol AB3 |
| B.容器内每减少1mol A2,同时消耗3mol B2 |
| C.混合气体总的物质的量不变 |
| D.密闭容器内的物质的质量不再改变 |
高温下,某反应达平衡,平衡常数K=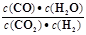 .恒容时,温度升高,H2浓度减小。下列说法正确的是()
.恒容时,温度升高,H2浓度减小。下列说法正确的是()
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
| D.该反应化学方程式为CO+H2O=CO2+H2 |
已知H2(g)+I2(g) 2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲、乙提高相同温度 | B.甲中加入0.1mol He,乙不改变 |
| C.甲降低温度,乙不变 | D.甲增加0.1molH2,乙增加0.1mol I2 |
在一定温度下,反应2SO2+O2 2SO3达到平衡时,n(SO2)∶n(O2)∶n(SO3 )=2∶3∶4,缩小体积,反应再次达到平衡。n(O2)=0.8 mol,n(SO3 )=1.4 mol,此时SO2的物质的量为 ( )
2SO3达到平衡时,n(SO2)∶n(O2)∶n(SO3 )=2∶3∶4,缩小体积,反应再次达到平衡。n(O2)=0.8 mol,n(SO3 )=1.4 mol,此时SO2的物质的量为 ( )
| A.0.4 mol | B.0.6 mol | C.0.8 mol | D.1.2 mol |