在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的是
① ②
②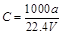
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-) > c(NH4+) > c(H+) > c(OH-)
| A.①④ | B.②③ | C.①③ | D.②④ |
用NA表示阿伏加德罗常数的值。则下列说法正确的是
| A.标准状况下,22.4L己烷中共价键数目为19NA |
| B.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32- |
| C.1cm3铁所含的铁原子数是ρ·NA/56(ρ是铁的密度,单位为g·cm-3) |
| D.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
下表列举的各组事实中存在因果关系的是
| 选项 |
陈述Ⅰ(原因) |
陈述Ⅱ(结果) |
| A |
O3能吸收紫外线 |
大气层中的O3被称为地球保护伞 |
| B |
钠原子核外电子数比铝少 |
钠的金属性比铝强 |
| C |
氯的非金属性比碘强 |
酸性:氢碘酸强于盐酸 |
| D |
N2+3H2  2NH3是放热反应 2NH3是放热反应 |
工业合成氨的反应在高温下进行 |
下列反应的离子方程式书写不正确的是
A.硫酸铜水解:Cu2++2H2O Cu(OH)2+2H+ Cu(OH)2+2H+ |
| B.澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+ CO32-+2H2O |
| C.氯化铝溶液加入过量的氨水:Al3++3NH3·H2O=A1(OH)3↓+3NH4+ |
| D.NaHSO4溶液中滴加NaHCO3溶液:H++ HCO3-=H2O+CO2↑ |
将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,反应后Fe有剩余,则容器中其它存在的单质或离子只能是
| A.Cu、Fe3+ | B.Fe2+、Fe3+ | C.Cu、Cu2+ | D.Cu、Fe2+ |