Cu(OH)2在水中存在着如下溶解平衡:Cu(OH)2(s)  Cu2+(aq)+2OH-(aq),在常温下Ksp[Cu(OH)2]=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调节溶液的pH,使溶液的pH大于
Cu2+(aq)+2OH-(aq),在常温下Ksp[Cu(OH)2]=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调节溶液的pH,使溶液的pH大于
| A.2 | B.3 | C.4 | D.5 |
下列各图与表述一致的是
A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.用图②所示装置蒸发AlCl3溶液制备无水AlCl3
C.图③可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化
D.图④电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B
关于有机物的叙述正确的是
| A.丙烷的二卤代物是4种,则其六卤代物是2种 |
| B.对二甲苯的核磁共振氢谱显示有3种化学环境的氢 |
| C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种 |
| D.某烃的同分异构体只能形成一种一氯代物,其分子式可能为C5H12 |
下列说法错误的是
| A.可利用废油脂制肥皂 |
| B.袋装食品常用生石灰包作为食品的抗氧化剂 |
| C.配制CuSO4溶液时加入少量的稀硫酸 |
| D.用钠和钠的化合物做焰色反应实验,焰色均为黄色 |
已知烯烃在酸性KMnO4溶液中双键断裂形式为: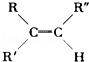
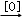
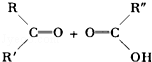 现有二烯烃C10H18与酸性KMnO4溶液作用后可得到三种有机物:(CH3)2CO、CH3COOH、CH3CO(CH2)2﹣COOH,由此推断此二烯可能的结构简式为
现有二烯烃C10H18与酸性KMnO4溶液作用后可得到三种有机物:(CH3)2CO、CH3COOH、CH3CO(CH2)2﹣COOH,由此推断此二烯可能的结构简式为
| A.(CH3)2C=C(CH3)CH2CH2CH=CHCH2CH3 |
| B.(CH3)2C=CHCH2CH2C(CH3)=CHCH3 |
| C.CH3CH=C(CH3)CH2CH2CH2C(CH3)=CH2 |
| D.CH3CH=C(CH3)CH2CH2CH2CH=CHCH3 |
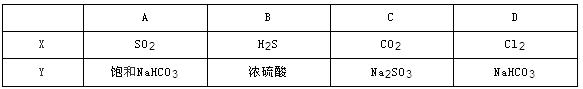
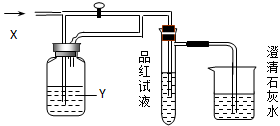
向下图装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞,则品红溶液退色,加热后又恢复红色。据此判断气体X和洗气瓶内溶液Y分别可能是