请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有_____种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,基态Ga原子的电子排布式为______。
(3)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为_______________________________。(用元素符号表示)
(4)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,该元素价电子排布图________,在周期表中的位置________,属于________区。
周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1:2。写出这些化合物的化学式。
现有某种不溶于水的金属氧化物,如要判别它是酸性氧化物、碱性氧化物还是两性氧化物,其方法是。
分别设计实验,用最佳方法证明明矾溶于水时发生的下列变化:
供选用的药品和仪器:明矾溶液、甲基橙试液、石蕊试液、酚酞试液、pH试纸、氢氧化钠溶液、酒精灯、半透膜、电泳仪、聚光束仪
(1)证明明矾溶于水发生了水解反应_______________;
(2)证明明矾的水解反应是一个吸热反应_______________;
(1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的c(HCO)变化趋势可能是:①逐渐减小;②逐渐增大;③先逐渐增大,而后减小;④先逐渐减小,而后增大。4种趋势中可能的是________。
(2) pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL。
①3种溶液中,物质的量浓度最大的是________。
②分别用0.1 mol/L的NaOH溶液中和,其中消耗NaOH溶液最多的是________。
③与等量的锌粉反应,反应开始时,反应速率________。
A.HCl最快B.H2SO4最快 C.CH3COOH最快D.一样快
(3)某温度下,纯水中c(H+)=2×10-7mol/L,则此时c(OH-)=________mol/L。相同条件下,测得:①NaHCO3溶液,②CH3COONa溶液,③NaClO溶液,3种溶液的pH相同,那么,它们的物质的量浓度由小到大的顺序是。
(4)已知:酸性H2CO3>HClO>HCO,判断在等浓度的NaClO、NaHCO3混合液中,各种离子浓度关系正确的是________
A.c(Na+)>c(HCO)>c(H+)>c(OH-)
B.c(HCO)>c(ClO-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO)+c(CO)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO)+c(ClO-)+c(OH-)+c(CO)
某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)此电极的正极发生的电极反应式是______________;
负极发生的电极反应式是___________________。
(2)电解液中的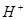 离子向____极移动;向外电路释放电子的电极是____极。(填正或负)
离子向____极移动;向外电路释放电子的电极是____极。(填正或负)
(3)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:
_______________。