溴化钙是一种溴化物,用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等。制备CaBr2·2H2O的主要流程如下: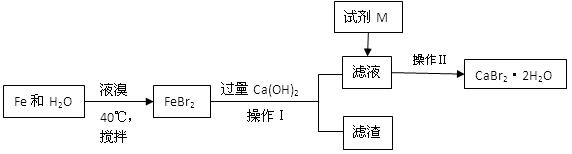
(1)与液溴的反应温度不能超过40℃的原因是 。
(2)滤渣的成分可能是 。
(3)试剂M是 ,加入M的目的是 。
(4)操作Ⅱ的步骤为蒸发浓缩、 、洗涤、干燥
(5)将氨气通入石灰乳,加入溴,于65°C进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式 。
(6)制得的CaBr2·2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量。得到2.00g固体,则CaBr2·2H2O的质量分数为 。(相对原子质量:Ca—40 Br—80 H—1 O—16)
氯气用途广泛,某中学化学兴趣小组设计了制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)制备氯气选用药品为:漂白粉固体和浓盐酸,相关的化学反应方程式为:。
(2)仔细观察装置B,该装置B的作用为。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入:。(选填字母序号)
| a |
b |
c |
d |
|
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是。但该现象不能说明溴的非金属性强于碘,原因是。
(5)氯气可用于自来水消毒,现已逐步被二氧化氯替代。ClO2不稳定,可与NaOH溶液、H2O2反应,转化为比较稳定的亚氯酸钠。该反应的化学方程式为。
用ClO2处理的自来水中会残留ClO2,可用FeCl2将其还原。现用V L(已换算为标准状况)ClO2处理一定量自来水,再加入a mol FeCl2可将残留的ClO2恰好除去。则该自来水中残留ClO2的物质的质量为g。
(6)某同学自己制备了漂白粉,他将制备产物溶于水,再加入酚酞后显红色,一会又变成无色,该同学据此判断,自己制备的漂白粉成分为Ca(OH)2、Ca(ClO)2。兴趣小组认为该同学的判断不正确,原因是。
有二氧化碳与一氧化碳的混合气体共10.8 g,其物质的量为0.3 mol。求:
(1)混合气体中二氧化碳与一氧化碳的物质的量各为多少?
(2)混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是什么?其质量为多少?所含分子数为多少?
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用如图所示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol·L-1的盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去。)
填写下列空白:
(1)实验进行时试管A中应加入的试剂是_________________;烧瓶B的作用是____________;烧瓶C的作用是_______________
(2)实验时,长颈漏斗H中应加入_____________________U型管G的作用是____________
(3)装置I中,在实验时需要加热的仪器是(填该仪器对应的字母)_____________ ;
当反应转移了4mol电子时,试管D中收集到的气体在标准状况下的体积为_____________。
(4)写出试管A中发生反应的化学方程式:________________________
50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程 中放出的热量可计算中和热。回答下列问题: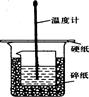
(1)烧杯间填满碎纸条的作用是 。
(2)从实验装置上看,图中缺少的仪器是 。
(3)实验中若用70mL0.50mol·L-1盐酸跟70mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”).
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会(填“偏大”“偏小”或“无影响”)。
由于Fe(OH)2极易被氧化;所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用图所示实验装置则可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(1)a电极材料为________,其电极反应式为_______________.
(2)电解液d可以是________,则白色沉淀在电极上生成;也可以是________,则白色沉淀在两极之间的溶液中生成。(填字母代号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是:;在加入苯之前,对d溶液进行加热煮沸处理的目的是:.
(4)为了在短时间内看到白色沉淀,可以采取的措施是。
A.改用稀硫酸做电解液
B.适当增大电源电压
C.适当缩小两电极间距离
D.适当降低电解液温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为:.
写出反接后两极的电极反应式:
阳极:
阴极: