下列反应的离子方程式正确的是
| A.NaHCO3溶液与盐酸:CO32−+ 2 H+ = H2O + CO2↑ |
| B.实验室制二氧化碳:CaCO3 + 2H+ = CO2↑ + H2O + Ca2+ |
| C.向硝酸亚铁溶液中加入稀硫酸:Fe2++4H++NO3-=Fe3++NO↑+2H2O |
| D.AlCl3溶液与过量氨水反应:Al3+ + 4NH3·H2O = AlO2-+ 4NH4+ + 2H2O |
下列实验操作与预期实验目的或实验结论不一致的是( )
| 选项 |
实验操作及现象 |
实验目的或结论 |
| A |
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
可证明氧化性:H2O2比Fe3+强 |
| B |
在0.1 mol/L的NaHCO3溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 |
验证盐类水解反应是吸热反应 |
| C |
将一定量的NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤 |
得到NaCl晶体 |
| D |
苯酚钠溶液中通入足量二氧化碳产生浑浊 |
苯酚的酸性弱于碳酸 |
有一无色透明溶液,可能含有Na+,Al3+,Mg2+,Fe3+,NH4+,Cl-,SO42—,HCO3—中的几种,取该溶液三份分别进行实验:①滴加甲基橙溶液显红色;②逐渐加入NaOH溶液,产生白色沉淀,最后白色沉淀部分溶解;③加入5 mL 0.1 mol·L-1 BaCl2溶液至不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.2 g沉淀。由此推知,原溶液中( )
| A.一定有Al3+,Mg2+,Cl-,SO42— |
| B.一定没有Mg2+,Fe3+,HCO3— |
| C.不能确定是否含有Cl- |
| D.可能有Na+,NH4+,Cl-,SO42— |
下列叙述正确的是( )
| A.丁达尔效应是区分溶液和胶体的一种常用物理方法 |
| B.氯化钠溶液蒸发结晶时,必须将蒸发皿中的液体蒸干才能停止加热 |
| C.实验室可用KOH稀溶液除去NaCl溶液中混有的少量MgCl2杂质 |
| D.测定某溶液的pH,常用干燥洁净的玻璃棒蘸取该溶液滴在润湿的pH试纸上 |
下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 |
结论 |
|
| A |
向装有Fe(NO3)2溶液的试管中加入稀硫酸,在管口观察到红棕色气体 |
HNO3分解成了NO2 |
| B |
向淀粉溶液中加入质量分数为20%的硫酸,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 |
淀粉没有水解成葡萄糖 |
| C |
甲烷和氯气混合后在光照下,颜色逐渐褪去 |
甲烷和氯气发生了化合反应 |
| D |
向饱和Na2CO3中通入足量CO2,溶液变浑浊 |
析出了NaHCO3 |
对于实验甲~丁的实验现象预测正确的是( )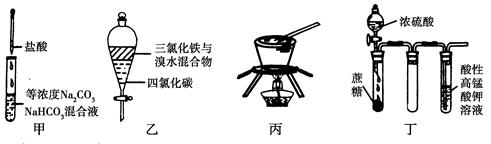
| A.实验甲:逐滴滴加盐酸时,试管中立即产生大量气泡 |
| B.实验乙:充分振荡后静置,下层溶液为橙红色,上层无色 |
| C.实验丙:从饱和食盐水中提取NaCl晶体 |
| D.装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去 |