有一无色透明溶液,取出少量滴入BaCl2溶液,只有白色沉淀生成;另取一定体积的无色溶液加入过量Na2O2,有无色无味气体产生,同时有白色沉淀生成,其沉淀量与加入Na2O2的量的关系如图所示,根据以上判断在①NH4+②H+③Al3+④Fe2+⑤Mg2+⑥NO3- ⑦CO32-⑧SO42-中一定存在的离子是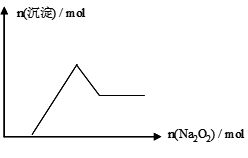
| A.②③⑤⑧ | B.③⑤⑦⑧ |
| C.③④⑤⑧ | D.②③⑤⑦⑧ |
下列说法正确的是
| A.若反应X + Y = M是放热反应,该反应一定不用加热。 |
| B.需要加热方能发生的反应不一定是吸热反应。 |
| C.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应。 |
| D.1 mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热。 |
下列气体中,只能用排水集气法收集,不能用排空气法收集的是
| A.NO | B.NH3 | C.C2H4 | D.CH4 |
阴离子Xn-含中子N个,X的质量数为A,则m g X元素的气态氢化物中含质子的物质的量是
A. |
B. |
C. |
D. |
①1mol 某链烃最多能和2mol HCl发生加成反应,生成1mol 氯代烷;②1mol 该氯代烷能和8 mol Cl2 发生取代反应,生成只含碳元素和氯元素的氯代烷。该链烃可能是
| A.CH2=CH2 | B.CH2=CHCH2CH=CH2 |
C.CH2=CHCH=CH2 | D.CH3CH=CH2 |
下列说法中正确的是
| A.凡是分子组成相差一个或若干个CH2原子团的有机物,彼此是同系物。 |
| B.两种化合物组成元素相同,各元素质量分数也相同,则二者一定是同分异构体。 |
| C.相对分子质量相同的几种化合物,互称为同分异构体。 |
D.组成元素质量分数相同,且相对分子质量也相同的不同 化合物,互为同分异构体。 化合物,互为同分异构体。 |