已知32 g X与40 g Y恰好完全反应,生成m g Q和9 g H,在相同条件下,16 g X和足量Y混合生成0.25 mol Q和若干摩的H,则物质Q的摩尔质量应是
| A.122 g·mol-1 | B.63 g·mol-1 |
| C.126 g·mol-1 | D.163 g·mol-1 |
甘氨酸和丙氨酸在一定条件下发生缩合反应生成的二肽化合物共有( )
| A.2种 | B.3种 | C.4种 | D.1种 |
下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是( )
A.淀粉 葡萄糖 葡萄糖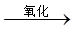 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
B.纤维素 葡萄糖 葡萄糖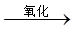 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
C.油脂 甘油和高级脂肪酸 甘油和高级脂肪酸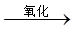 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
D.蛋白质 氨基酸 氨基酸 人体所需的蛋白质(人体生长发育) 人体所需的蛋白质(人体生长发育) |
百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧。其主要化学成分的结构简式为: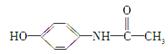 。下列有关该有机物叙述正确的是( )
。下列有关该有机物叙述正确的是( )
| A.分子式为C8H10NO2 |
| B.该有机物属于α氨基酸 |
| C.其属于α氨基酸的同分异构体有3种 |
| D.该有机物可与FeCl3溶液发生显色反应 |
市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣服的汗渍、血迹及人体排放的蛋白质油渍遇到它都能水解而除去。下列衣料中不能用加酶洗衣粉洗涤的是( )
①棉织品 ②毛织品 ③腈纶织品 ④蚕丝织品 ⑤涤纶织品 ⑥锦纶织品
| A.①②③ | B.②④ | C.③④⑤ | D.③⑤⑥ |
关于蛋白质的下列叙述正确的是( )
A.加热会使蛋白质变性,因此生吃鸡蛋比熟吃好
B.一束光线照射蛋白质溶液,产生丁达尔现象
C.向鸡蛋清中加入食盐,会使蛋白质变性
D.天然蛋白质中仅含C、H、O、N四种元素