氯化钠是生活必需品,也是重要的化工原料.提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作①中必须用到的一种仪器是________(填序号).
(A)研钵
(B)量筒
(C)烧杯
(D)试管
(2)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是________(填序号).
(3)操作⑤中除用到三脚架、酒精灯、玻璃棒、坩埚钳外,还需要用到________等仪器.该操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取________等措施.
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是________(填序号).
(A)食盐没有全部溶解即过滤
(B)蒸发时食盐飞溅剧烈
(C)蒸发后,所得精盐很潮湿
(D)器皿上沾有的精盐没全部转移到称量纸上
某班级的探究小组同学在学习了催化剂的知识后,上网查阅,获得以下信息: (1)氯酸钾 氯化钾+氧气
氯化钾+氧气
(2)碳+氧化铜 铜+二氧化碳
铜+二氧化碳
(3)黑色氧化铜不溶于水,氯化钾、氯酸钾易溶于水
他们想研究氧化铜能否在氯酸钾的受热分解反应中起催化剂的作用,设计了以下的对比实验和后续操作。
①任取两份氯酸钾,分别放入两支相同的试管中,在其中一份中加入精确称量的n g氧化铜粉末。
②将两份氯酸钾同时在相同条件下正确加热,将放出的气体通入水中,观察放出气体的快慢。
③停止加热,冷却,将原来混有氧化铜的反应后的混合物加水溶解,小心过滤,得出滤出物,洗涤并干燥。
④观察滤出物的状态和颜色。
⑤将滤出物和炭粉混合,在密闭容器中高温加热,将反应后产生的气体通入澄清石灰水中,并观察实验现象。
(1)以上实验步骤,有一步不够严密,请你指出是哪一步?_________。
(2)要达到实验目的,除改进不严密的实验步骤外,还必须增加一个实验步骤,这个实验步骤是_________________________。
(3)实验⑤的目的是什么?为达到此目的,我们还可如何操作?
如图所示装置可粗略地测定空气中氧气和氮气的体积比。分析下列各步操作,回答问题:
(1)在试管底部铺一层细沙,并放一小块擦干的白磷,先关闭活塞,把螺旋状铜丝在酒精灯上加热后迅速插入大试管中并接触白磷,将胶塞塞紧,观察到的现象是_______________________________________________________,白磷燃烧的文字表达式是______________________________________________。
(2)待试管冷却后,打开活塞,观察到的现象是__________________________________;证明空气中氧气和氮气的体积比为_________;此实验同时说明氧气具有____________的性质,氮气的性质是①_______________________②__________________________。
(3)上述实验可用来测定空气中的含氧量,在做实验时,若水的高度没有达到预期的高度,这可能是由哪些原因引起的___________________;___________________;_______________________________________________。
(4)同学们又设计了如下图所示的方案一和方案二来测定氧气含量。
方案一方案二
两个方案的实验测定结果不同,测定结果比较准确的是方案,原因是。
(典型例题)为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40 mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管口,通过导管与实际容积为60 mL且润滑性很好的针筒注射器组成如图的实验装置。
假设此实验能按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答
下列问题:
(1)实验前,打开弹簧夹,将注射器的活塞前沿从20 mL刻度处推至15mL刻度处,然后松手,若活塞仍能返回至20mL刻度处,则说明____________________。
(2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹。
可观察到的现象为_______________________________________________。
(3)若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却。可观察到的现象为______________________________________________________________。
(4)若按小华的设想进行实验,实际可能遇到诸多问题而发生危险,造成实验失败。例如______________________________________________________________________。
(典型例题)为测定空气中氧气所占的体积分数,某同学设计如图所示的实验,在一个耐热活塞的底部放一小块(足量)白磷(白磷在空气中燃烧的温度为40 ℃),然后迅速将活塞下压,可以观察到的现象为;冷却至原来温度时,松开手,活塞最终将回到刻度处,试回答白磷燃烧的原因。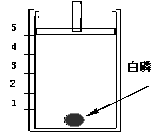
(典型例题)小军根据燃烧红磷测定空气中氧气含量的实验原理,认为可用木炭替代红磷测定空气中氧气的含量,并按下图所示装置进行实验。
(1)依据的实验原理是_______________________________。
小军检查装置气密性后,将盛有足量红热木炭的燃烧匙迅速伸入广口瓶中,并把塞子塞紧,待红热的木炭熄灭并冷却至室温后,就打开弹簧夹,并未发现倒吸现象。经过认真分析,小军发现实验失败的原因是(答一条)________________________________________________。
(2)小军反思上述实验的探究过程后认为:用燃烧法测定空气中氧气含量的实验时,在药品的选择和生成物的要求上应考虑的是(答一条)_____________________________。