实验是化学研究的一种重要手段,现有下图所示A~G七种仪器,请根据要求填空。
(1)写出仪器名称:E ,F
(2)下列实验操作中用到仪器G的是 (选填下列选项的编号字母)。
a.分离水和CC14的混合物
b.分离水和酒精的混合物
c.分离水和泥砂的混合物
(3)实验室配制100mL 0.5mol/L的盐酸溶液。
①下列关于仪器E的使用方法中,正确的是 (选填下列选项的编号字母)。
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.热溶液可直接转移到容量瓶中
②需要10mol/L的浓盐酸 mL。取用该体积盐酸时,需要用到上述仪器中的A和 (选填仪器的编号字母)。
已知离子反应:Fe3++3SCN- Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红
色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气
体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变
浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应时被氧化的元素是____________(填元素符号)。根据元素C、S、N的原子结构和共价键的相关知识推断出SCN-的结构式为_________________。
(4)实验②中反应的离子方程式为___________________________________________。
(5)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意_________________________________________________________________.
铁触媒(铁的某氧化物)是工业合成氨的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列流程测定铁触媒的含铁量,确定其组成。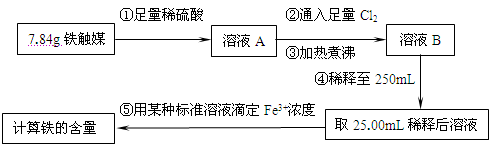
(1)步骤④后面需用(填仪器名称)取25.00mL稀释后溶液。
(2)因为通入Cl2不足量,“溶液B”中还含有会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
| 实验操作 |
实验现象与结论 |
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成。
(4)“干燥管C”的作用是。
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为。(相对原子质量:C-12 O-16Fe-56)
ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景。某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)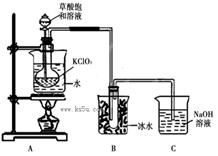
已知信息:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃。与碱反应和氯气相似。
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。
(1)制备ClO2的化学方程式:2KClO3+H2C2O4= 2KHCO3+2ClO2↑;下列说法正确的是
| A.KClO3在反应中得到电子 |
| B.ClO2是氧化产物 |
| C.H2C2O4在反应中失去电子 |
| D.1mol KClO3参加反应有2mol电子转移 |
(2)A装置中还缺少的一样仪器名称是__________,
若将A中烧杯去掉,让烧瓶直接加热是否可以,为什么?_________________________。
(3)C装置吸收尾气后,溶液中含有NaOH、Na2CO3等溶质,该同学认为C中还可能含有NaClO2、NaClO3,试分析可能的原因,并写出有关化学方程式________。
(4)实验室还可通过以下反应制得ClO2:
KClO3+H2C2O4+H2SO4= ClO2↑+K2SO4+CO2↑+H2O.
配平上述方程式。0.5 mol KClO3参加反应有个电子转移。
某研究性学习小组拟取盐湖苦卤的浓缩液(富含Ca2+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的无水CaCl2及液溴,他们设计了如下流程:
回答以下问题:
(1)操作Ⅰ中加入的试剂1是;在从橙色液体中分离出溴时,可能会导致收集到的产品中混有低沸点杂质的装置(见图A、B、C、D)是。
(2)加入溶液W的目的是。
(3)操作Ⅲ所用的仪器除三脚架、酒精灯,还需要。
(4)某同学用如上图E所示的实验装置制取操作1前的氧化剂,写出该反应的离子方程式,试简述该装置气密性的检验方法。
某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。 
(1)能说明有SO2气体产生的实验现象是。
(2)图2中导气管e的主要作用为。
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:
。
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是。
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为确认溶液的成分,选用如下试剂:
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
E.NaOH溶液 F.H2O2溶液
试完成下列相关的实验探究:
实验步骤 |
实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 |
(1) ,则说明Ⅱ成立。 (2) ,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立。 |
| 2、 |
。 |