已知反应X + Y =" M" + N为吸热反应,对这个反应的下列说法中正确的是
| A.X和Y的总能量一定低于M和N的总能量 |
| B.因为该反应是吸热反应,故一定要加热反应才能进行 |
| C.X的能量一定低于M的能量,Y的能量一定低于N的能量 |
| D.破坏反应物中的化学键所吸收的能量小于形成生成物化学键所放出的能量 |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4 +Na2CO3主要:Cu2+ + CO32─ + H2O = Cu(OH)2↓+ CO2↑
次要:Cu2+ + CO32─= CuCO3↓
(2)CuSO4 +Na2S主要:Cu2+ + S2─= CuS↓
次要:Cu2+ + S2─+ 2H2O = Cu(OH)2↓+ H2S↑
则下列几种物质的溶解度大小的比较中,正确的是
| A.CuS <Cu(OH)2<CuCO3 | B.CuS >Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2<CuCO3<CuS |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作及现象 |
实验目的或结论 |
| A |
向1,2两试管中分别加入等浓度H2O2溶液10 mL、1 mL,再向H2O2溶液中分别滴入等浓度等体积CuSO4、FeCl3溶液;试管2中产生气体较快 |
证明FeCl3溶液的催化效率更高 |
| B |
硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 |
证明非金属性:Cl>Si |
| C |
测定物质的量浓度相同的盐酸和醋酸溶液的pH;盐酸pH小于醋酸pH |
证明盐酸酸性比醋酸强 |
| D |
取5 mL,0.1mol/L的AgNO3溶液于试管中,向试管中加入1-2滴0.1mol/L的NaCl溶液,出现白色沉淀,再向该试管中加入2滴0.1mol/L的KI溶液,出现黄色沉淀(AgI沉淀为黄色)。 |
证明: Ksp(AgI) >Ksp(AgCl) |
已知常温、常压下,饱和CO2溶液的pH为3.9,则可推断用已知浓度的盐酸滴定未知浓度的NaHCO3溶液时,应选用的指示剂及滴定终点的颜色变化是
| A.石蕊、由蓝变红 | B.酚酞、红色褪去 |
| C.甲基橙、由橙变黄 | D.甲基橙、由黄变橙 |
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是
| A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- |
| B.室温下,c(H+)/c(OH-)=1012的溶液:Cu2+、Na+、Mg2+、NO3- |
| C.室温下,水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D.所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ |
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-), 根据图示判断,下列说法正确的是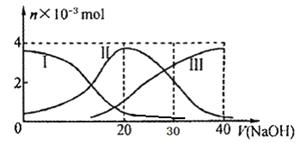
A.H2A在水中的电离方程式是:H2A===H++HA-;HA-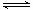 H++A2-
H++A2-
B.当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中水的电离程度大
D.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+ c(HA-)+ 2c(H2A)=c(A2-)+ 2 c(OH-)