请根据所学化学知识回答下列问题:
(1)氯化铁溶液蒸干并灼烧后得到的固体物质的化学式是________。
(2)在浓度均为0.1 mol/L的①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4四种溶液中,NH4+浓度由大到小的顺序为________(用代号表示)。
(3)25时,某浓度的CH3COONa溶液呈碱性的原因是________(用离子方程式表示),溶液中所有离子的浓度由大到小的顺序是________。
(4)某温度下,蒸馏水的pH = 6,氢氧化物R(OH)2的Ksp = 1×10-13,则R2+沉淀完全时,溶液的pH为_______。
在一定条件下,向体积为2 L的容器中加入2 molO2和3 molSO2进行可逆反应:2SO2(g)+ O2(g) 2SO3(g),2 min后测得O2的物质的量为1.6 mol,则:
2SO3(g),2 min后测得O2的物质的量为1.6 mol,则:
(1)2 min内,SO2的物质的量减少了,SO3的物质的量增加了;
(2)若用O2的浓度变化来表示该反应的反应速率,则v(O2)=;
(3)若用SO3的浓度变化来表示该反应的反应速率,则v(SO3)=。
已知氢化钠(NaH)属于离子化合物,NaH跟水反应可以放出氢气。则
(1)NaH与水反应的化学方程式为,氧化剂为________,氧化产物为________,生成1mol H2转移电子mol;
(2)NaH中的两种离子,离子半径小的是_____ (填离子符号);
(3)如何通过实验证明NaH属于离子化合物?___________________________ 。
(7分)短周期元素A、B、C、D原子序数依次增大。已知A与D同主族,B与C同周期,A元素原子核外只有1个电子,B元素原子的最外层电子数是次外层电子数2倍,C元素原子的电子总数是电子层数的4倍,回答下列问题:
(1)B元素在周期表中的位置是________________;B元素能形成金刚石、石墨、C60等多种单质,这几种单质互称为_________________。
(2)C元素与A 元素形成的化合物A2C常温下可D元素的单质发生剧烈反应,该反应的离子方程式为:______________。
(3)B元素最高价氧化物X与D元素最高价氧化物对应水化物Y发生反应可生成两种盐
(酸式盐和正盐),写出由X和Y两种化合物反应生成正盐的化学方程式:_________________________。
(11分)在Ar、KCl、CO2、SiO2、NaOH等物质中[(1)题填物质的名称]
(1)构成各物质的微粒中,只存在离子键的是____;只存在共价键的是_______;既存在离子键又存在共价键的是_________;不存在化学键的是_________。
(2)在上述化合物中,固态时属于原子晶体的是____;属于分子晶体的是_______属于离子晶体的是________。
(3)KCl的电子式是________,CO2的电子式是________。
莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种同分异构体。A的结构简式如图: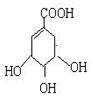
(1)A的分子式是;
(2)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)是:,反应类型为反应;
(3)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是:;
(4)A与氢气反应的化学方程式(有机物用结构简式表示)是:;
(5)A在浓硫酸作用下加热可得到B(B的结构简式为HO- -COOH),其反应类型是_______反应;
-COOH),其反应类型是_______反应;
(6)B的同分异构体中既能与FeCl3溶液发生显色反应又能发生水解反应的有种,
写出其中一种同分异构体的结构简式。