(1)如图所示,烧杯甲中盛放100 mL 6 mol·L-1的HCl溶液,烧杯乙中盛放100 mL冷水,现向烧杯甲的溶液中放入NaOH固体,同时向烧杯乙中放入NH4NO3固体,搅拌使之溶解。A瓶中气体颜色变深,B瓶气体颜色变浅,理由是: 。

(2)在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如下图。

①图中的两条曲线,表示NO2浓度随时间的变化曲线
②前10 min内用υ(N2O4)表示的化学反应速率为
③25 min时,NO2转变为N2O4的反应速率增大,其原因是
④15min时的平衡常数为 ,35min时的平衡常数为 。
⑤在一定容积的密闭容器中,不能说明2NO2(g) N2O4(g)达到平衡状态的是( )
N2O4(g)达到平衡状态的是( )
| A.容器的压强不再变化 |
| B.容器的颜色不再变化 |
| C.混合气体的平均相对分子质量不再变化 |
| D.混合气体的密度不再变化 |
E.υ(NO2)=2υ(N2O4)
F.c(NO2)=2 c(N2O4)
某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 |
铁的质量/g |
铁的 形态 |
V(H2SO4) /mL |
c(H2SO4) /mol·L-1 |
反应前溶液 的温度/℃ |
金属完全消 失的时间/s |
| 1 |
0.10 |
片状 |
50 |
0.8 |
20 |
200 |
| 2 |
0.10 |
粉状 |
50 |
0.8 |
20 |
25 |
| 3 |
0.10 |
片状 |
50 |
1.0 |
20 |
125 |
| 4 |
0.10 |
片状 |
50 |
1.0 |
35 |
50 |
请分析上表信息,回答下列问题。
(1)实验1、2 表明 对反应速率有影响。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是。(忽略温度对反应速率的影响)
(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。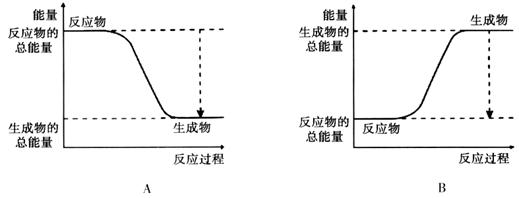
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
| 化学键 |
H—H |
O=O |
H—O |
| 键能kJ/mol |
436 |
496 |
463 |
则生成1mol水可以放出热量 kJ
(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是(填“Cu”或“Fe”); 若Zn、Ag和稀盐酸构成原电池,正极发生反应(填“氧化”或“还原”),电解质溶液中阳离子移向极(填“正”或“负”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为;X为。若反应经2min达到平衡,平衡时C的浓度0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为;X为。若反应经2min达到平衡,平衡时C的浓度0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为。
(10分)塑化剂是工业上被广泛使用的高分子材料助剂,在塑料加工中添加这种物质,可以使其柔韧性增强,容易加工。塑化剂可合法用于工业生产,但禁止作为食品添加剂。截止2011年6月8日,台湾被检测出含塑化剂食品已达961种,据媒体报道,2012年岁末,我国大陆多种著名品牌白酒也陷入了塑化剂风波。
常见塑化剂为邻苯二甲酸酯类物质,某有机物J(C19H20O4)是一种塑料工业中常用的塑化剂,可用下列合成路线合成。
已知:Ⅰ.
Ⅱ.控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应;
Ⅲ.F与浓溴水混合不产生白色沉淀。
请回答下列问题:
(1) F中官能团的电子式为________。
(2)写出反应①④的化学反应方程式:
反应①________________________________。反应④________________________________。
(3)C4H10O的同分异构体中属于醇类的有多种,写出其中具有手性碳原子的同分异构体的结构简式:________________。
(4)以含碳原子数不同的苯的同系物为原料,可以合成不同种类的塑化剂。教材中苯及其同系物的通式是CnH2n-6(n≥6),某同学根据等差数列公式推导出该系列的通式却是Cn+5H2n+4,老师告诉该同学他推导出的通式也是正确的,但其中n的意义和取值范围与教材中的通式不同,请问:通式Cn+5H2n+4中n的意义是________。
(10分)2014年4月,英国《每日邮报》报道制造太阳镜、婴儿奶瓶、太空杯和光盘的主要材料都是聚碳酸酯,聚碳酸酯在一定条件下可释放出有毒的双酚A( )。聚碳酸酯不耐高温,100 ℃时释放出的双酚A是25 ℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
)。聚碳酸酯不耐高温,100 ℃时释放出的双酚A是25 ℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
Ⅰ.下列关于双酚A的说法不正确的是________(填序号)
A.利用聚碳酸酯制成的茶杯来泡茶时对人体无害
B.双酚A的分子式是C15H16O2
C.双酚A的核磁共振氢谱显示有4组峰,且峰面积之比为1∶2∶2∶3
D.1 mol双酚A最多消耗2 mol Br2
Ⅱ.聚碳酸酯(简称PC)是分子链中含有碳酸酯基的高分子聚合物,其合成流程如下:
(1)反应①②③④⑤中属于取代反应的有________。
(2)CH3CH==CH2与Cl2加成产物的同分异构体有________种(不含加成产物)。
(3)写出反应⑤⑦的化学方程式:
反应⑤________________________。反应⑦________________________。
(8分)下列是八种环状的烃类物质:
(1)金刚烷的一氯取代产物有________种,立方烷的二氯取代产物有________种。
(2)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):______________________、______________________。
(3)以立方烷的一种属于芳香烃的同分异构体为起始物质,通过一系列反应可制得苯乙炔,写出有关化学方程式(所需的试剂自选): ____________________________。