对于相同物质的量的SO2和SO3,下列说法中正确的是
| A.硫元素的质量比为5:4 | B.分子数之比为1:1 |
| C.原子总数之比为4:3 | D.质量之比为1:1 |
关于物质的类别或成分,下列说法正确的是
| A.食盐水、糖水和冰水都是饮料,故都属于混合物 |
| B.盐酸、硫酸、硝酸、NaHSO4都能电离出氢离子,故都属于化合物中的酸 |
| C.石灰水的主要成分是CaO,石灰石的主要成分是CaCO3 |
| D.烧碱属于碱,纯碱属于盐 |
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是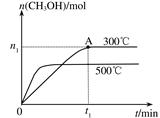
| A.该反应的△H<0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
C.300℃时,0-t 1min内 CH3OH的平均生成速率为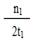 mol·L-1 min-1 mol·L-1 min-1 |
D.A点的反应体系从300℃升高到500℃,达到平衡时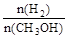 减小 减小 |
在水溶液中,重铬酸钾K2Cr2O7存在以下平衡: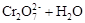

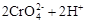 ,下列说法正确的是
,下列说法正确的是
| A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色 |
| B.该反应不是氧化还原反应 |
| C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大 |
D.该反应的平衡常数表达式是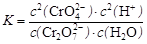 |
在容积固定不变的密闭容器中加入1 mol N2和3 mol H2发生反应,下列叙述正确的是
| A.该反应的热化学方程式为: N2+3H2  2NH3ΔH =-92 kJ·mol-1 2NH3ΔH =-92 kJ·mol-1 |
| B.达到平衡后向容器中通入1 mol氦气,平衡不移动 |
| C.降低温度和缩小容器体积均可使该反应的平衡常数增大 |
| D.图中曲线b表示使用了催化剂 |

从下列事实所得出的解释或结论正确的是
| 选项 |
实验事实 |
解释或结论 |
| A |
2N2O5(g) 4NO2(g)+O2(g)ΔH>0 4NO2(g)+O2(g)ΔH>0在室温下能自发进行 |
这是一个熵增的反应 |
| B |
压缩针筒内的NO2和N2O4混合气体, 颜色先变深后变浅 |
增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C |
锌与稀硫酸反应过程中,开始反应后速率逐渐增大 |
该反应是放热反应 |
| D |
已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 |
反应物的浓度一定降低 |