(12分)(1)已知在一定温度下:C(s)+CO2(g) 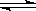 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) 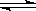 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g)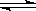 H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是: 。
(2)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阳极的电极反应式是 。
。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,装入锥形瓶中,用一定浓度的标准I2溶液进行滴定,所用指示剂为 ,滴定终点时的颜色变化为 。
(4)用标准NaOH溶液滴定盐酸时,滴定前俯视读数,滴定后仰视读数,会造成测定结果 。(填“偏大”、“偏小”或“无影响”)
(5)如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是 。
把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为 。
(6)怎样除去锅炉中难溶的硫酸钙沉淀?
(7)某温度下,水的离子积常数Kw = 1.0×10-12mol2·L-2。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,当混合溶液的pH=7时,H2SO4溶液与NaOH溶液的体积比为 。
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途。
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图。
①下列对尼泊金酯的判断不正确的是______。
a.能发生水解反应
b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上
d.与浓溴水反应时,1 mol尼泊金酯消耗1 mol Br2
②尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是,其中包含的反应类型有、。
(2)C8H8O3的另一种同分异构体甲满足以下条件:
①与足量的NaOH溶液完全反应时,1 mol甲消耗3 molNaOH
②遇FeCl3溶液显色③ 苯环上的一氯取代物只有一种,甲可能的结构简式是、。
以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:



 (1)反应I前需在FeSO4溶液中加入(填字母),以除去溶液中的Fe3+。
(1)反应I前需在FeSO4溶液中加入(填字母),以除去溶液中的Fe3+。
| A.锌粉 | B.铁屑 | C.KI溶液 | D.H2 |
 (2)反应Ⅰ需控制反应温度低于35℃,其目的是。
(2)反应Ⅰ需控制反应温度低于35℃,其目的是。 (3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是。 (4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为。
 工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
 (1)氨催化氧化的化学方程式为:
(1)氨催化氧化的化学方程式为: (2)原料气中空气必须过量,其主要原因是;
(2)原料气中空气必须过量,其主要原因是; (3)将铂铑合金做成薄丝网的主要原因是;
(3)将铂铑合金做成薄丝网的主要原因是; (4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为,为了提高水对二氧化氮的吸收率,可采取的措施为(答2项)。
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为,为了提高水对二氧化氮的吸收率,可采取的措施为(答2项)。
工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%O2 11% N2 82%);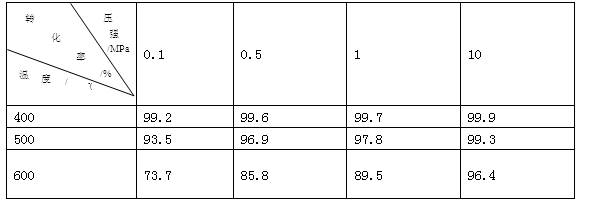
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论? ;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是: ;
(3)选择适宜的催化剂,是否可以提高SO2的转化率?(填“是”或“否”),是否可以增大该反应所放出的热量?(填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
28g KOH固体必须溶解在________g水中,才能使每200个水分子中有1个K+,所得溶液的密度为ρg/cm3,则该溶液中OH-的物质的量浓度为________。(保留到小数点后两位)