在一个1 L的密闭容器中,加入2 mol A和1 mol B,发生下列反应:
2A(g) + B(g)  3C(g) + D(s), 达到平衡时,C的浓度为1.2 mol·L-1。
3C(g) + D(s), 达到平衡时,C的浓度为1.2 mol·L-1。
(1)维持容器的温度不变,若将容器的体积缩小至一半,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),C的浓度为 mol/L,平衡常数K= 。
(2)能说明该反应达到化学平衡状态的是
a.容器中气体总压强不再改变 b.容器中气体的密度不再改变
c.2V正(A)=3V逆(C) d.气体平均相对分子质量不再改变
(3)维持容器的压强和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2 mol·L-1的是 。
a.4 mol A + 2 mol B
b.3 mol C + 1 mol D
c.2 mol A +1 mol B + 1 molD
(4)若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2 mol·L-1,则C的起始物质的量应满足的条件是 。
有甲、乙两种物质: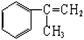
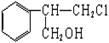
甲乙
(1)乙中含有的官能团的名称为____________________(不包括苯环)。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):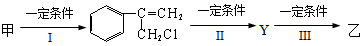
其中反应I的反应类型是___________,反应II的条件是_______________,反应III的化学方程式为___________________________________(不需注明反应条件)。
(3)下列物质不能与乙反应的是(选填序号)。
a.金属钠 b.溴水 c.碳酸钠溶液 d.氢氧化钠溶液
(4)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式。
a.苯环上的一氯代物有两种 b.遇FeCl3溶液显示紫色
某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A消耗氧气的量不相等的是(填序号)________。
a.C7H12O2b.C6H14c.C6H14Od.C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。
则A的结构简式为________________;
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A的名称为__________________。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为______________。
按要求填写:
(1)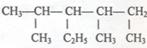 (系统命名)
(系统命名)
(2)(CH3)2CHCH(CH3)C≡CCH(CH3)2(系统命名)
(3)4,4,5-三甲基-2-己醇(写出结构简式)
根据下列4组物质的结构简式回答:
① CH4和CH3CH3② CH=CHCH3和CH3CH=CH2
③ ④ C2H5OH和CH3OCH3
④ C2H5OH和CH3OCH3
(1)属于同系物的是。(2)属于同一物质的是。
(3)具有不同官能团的同分异构体是。
(4)由于碳链骨架不同而产生的同分异构体是。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)用电子式表示X与W组成的化合物的形成过程;
(2)由X与Z组成的某化合物中存在非极性键,则该化合物的分子式为;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液不能与铜反应,浓溶液能与铜在加热条件下反应,该反应的化学方程式为:;
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH浓溶液反应的离子方程式:;
②又知A既能与盐酸反应,又能与氯水反应,写出与盐酸反应的离子方程式:;
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1molB中含有6 mol结晶水。对化合物B进行如下实验:
取B的溶液加入足量的NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
另取B的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.
由上述实验现象可知:B的化学式为。